题目内容
9.若以w1和w2分别表示物质的量浓度为a mol/L和b mol/L氨水的溶质质量分数,且w2=2w1,则下列判断正确的是( )| A. | 2a=b | B. | a=2b | C. | 2a<b | D. | a<b<2a |
分析 根据c=$\frac{1000ρω}{M}$计算氨水的物质的量浓度,结合氨水的浓度越大密度越小,进行判断.
解答 解:设质量分数w1的氨水密度为ρ1g/ml,质量分数w2的氨水的为ρ2g/ml.
质量分数w1的氨水的物质量浓度为a=$\frac{1000×{ρ}_{1}×{w}_{1}}{17}$mol/L.
质量分数w2的氨水的物质量浓度为b=$\frac{1000×{ρ}_{2}×{w}_{2}}{17}$mol/L.
由于2w1=w2,所以a<b,
氨水的浓度越大密度越小,所以ρ1>ρ2.
$\frac{a}{b}$=$\frac{\frac{1000×{ρ}_{1}×{w}_{1}}{17}}{\frac{1000×{ρ}_{2}×2{w}_{1}}{17}}$=$\frac{{ρ}_{1}}{2{ρ}_{2}}$,则b<2a;
所以a<b<2a.
故选:D.
点评 本题考查物质的量浓度的有关计算,难度中等,可利用定义计算浓度,关键理解物质的量浓度定义,注意氨水、酒精的浓度越大、密度越小.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
19.将质量分数为x的氨水与水等质量混合,质量分数为a,若与水等体积混合,质量分数为b,将质量分数为x的NaOH溶液与水等体积混合,质量分数为c,则a、b、c大小关系为( )
| A. | a>b>c | B. | c>a>b | C. | b>c>a | D. | b>a>c |
20.获得“863”计划支持的环境友好型铝碘电池已研制成功,电解质溶液为AlI3溶液,电池总反应式为2Al+3I2═2AlI3.下列说法不正确的是( )
| A. | 该电池负极的电极反应为:Al-3e-=Al3+ | |
| B. | 电池工作时,溶液中铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 | |
| D. | 当导线中有3.612×1024个电子通过时,电池负极质量减少27g |
4.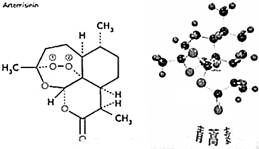 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素易溶于水 | ||
| C. | 1mol 青蒿素不能发生还原反应 | D. | 青蒿素中碳原子共有三种杂化方式 |
14.下列实验中,不能观察到明显反应现象的是( )
| A. | 向氯化银悬浊液中滴加0.1mol/L Na2S溶液 | |
| B. | 向50mL NO中通入5mL空气 | |
| C. | 98%浓硫酸中加入Cu片 | |
| D. | 把盐酸滴加到含酚酞的NaOH溶液中 |
5.实验室以氯化铁腐蚀印刷电路铜板后的溶液(简称“腐蚀废液”)为主要原料来制备氯化铁晶体,从而重新用作腐蚀印刷电路铜板的试剂.该制备流程如图: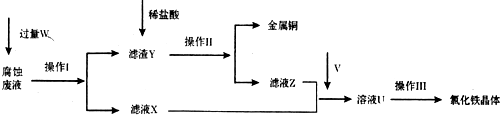
请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+ (填离子符号)先沉淀,Ksp[Mg(OH)2]>Ksp[Fe(OH)2](填“>”、“=”或“<”).

请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Cu2+ | Fe2+ | Mg2+ |
| pH | 5.2 | 7.6 | 10.4 |
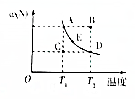 一定条件下,在某密闭恒压容器中发生反应:2M(g)?N(g)△H=a kJ•mol-1,达到平衡时,N的质量分数[ω(N)]与温度的变化关系如图所示:
一定条件下,在某密闭恒压容器中发生反应:2M(g)?N(g)△H=a kJ•mol-1,达到平衡时,N的质量分数[ω(N)]与温度的变化关系如图所示: