题目内容
15.Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是C.分析 Ni原子外围电子排布为3d84s2,未成对电子数为2,第二周期基态原子未成对电子数的外围电子排布为2s22p2或2s22p4,同周期自左而右电负性增大,据此分析.
解答 解:Ni原子外围电子排布为3d84s2,未成对电子数为2,第二周期基态原子未成对电子数的外围电子排布为2s22p2或2s22p4,同周期自左而右电负性增大,故未成对电子数与Ni相同且电负性最小的元素是C;
故答案为:C.
点评 本题是对物质结构的考查,涉及核外电子排布以及电负性的比较等,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
5.实验室以氯化铁腐蚀印刷电路铜板后的溶液(简称“腐蚀废液”)为主要原料来制备氯化铁晶体,从而重新用作腐蚀印刷电路铜板的试剂.该制备流程如图: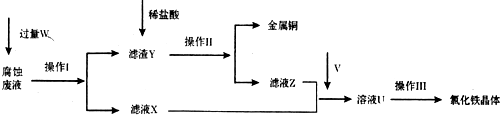
请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+ (填离子符号)先沉淀,Ksp[Mg(OH)2]>Ksp[Fe(OH)2](填“>”、“=”或“<”).

请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Cu2+ | Fe2+ | Mg2+ |
| pH | 5.2 | 7.6 | 10.4 |
3.下列有机物:①硝基苯;②环己烷;③甲苯;④苯磺酸;⑤溴苯;⑥异丙苯.其中不能由苯通过一步反应直接制取的是( )
| A. | ②④ | B. | ③ | C. | ①⑤②⑥ | D. | ③⑥ |
20.制备食用碘盐(KIO3)原理之一为:I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3,下列说法不正确的是( )
| A. | KClO3和KIO3均属于离子化合物,含有离子键和共价键 | |
| B. | 为防止反应的尾气造成大气污染,可以用碱性溶液吸收尾气 | |
| C. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| D. | 制备KIO3的反应中I2被氧化 |
7.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).原子结构示意图为 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦、①与⑥形成的化合物的电子式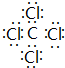 、
、 .
.
(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦、①与⑥形成的化合物的电子式
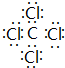 、
、 .
.(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
4.反应4A(s)+3B(g)═2C(g)+D(s),经2min,B的浓度减少0.6mol/L.对此化学反应速率的正确表示是( )
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 分别用B、C表示反应的速率,其比值是3:2 | |
| C. | 在2 min末的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 在这2 min内B和C两物质浓度都逐渐减小 |
5.在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | 2S(g)+O2(g)═2SO2(g);△H1 2S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |