题目内容
14. (1)“冰甲烷”即甲烷的结晶水合物,是一种晶体,该晶体中平均每46个水分子构成8个笼,每个笼可容纳一个甲烷分子或一个游离水分子,若该晶体中每8个笼只有6个容纳甲烷分子,另外2个被游离水分子填充,则“冰甲烷”平均组成可表示为B(填序号).
(1)“冰甲烷”即甲烷的结晶水合物,是一种晶体,该晶体中平均每46个水分子构成8个笼,每个笼可容纳一个甲烷分子或一个游离水分子,若该晶体中每8个笼只有6个容纳甲烷分子,另外2个被游离水分子填充,则“冰甲烷”平均组成可表示为B(填序号).A.CH4•6H2O B.CH4•8H2O C.CH4•10H2O D.CH4•14H2O
(2)“冰甲烷”中的水分子与甲烷分子以分子间作用力相结合形成分子晶体;
(3)由无水醋酸钠与碱石灰共热可制得甲烷,你预测将无水苯乙酸钠与碱石灰共热时,所得的有机物主要是B(选填序号)
A.甲烷 B.甲苯 C.苯甲酸钠、甲烷 D.乙苯
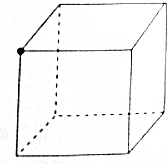
(4)将甲烷分子中的4个氢原子互相连接可以构成一个正四面体,如图所示是一个正方体,设想将一个甲烷分子放入,碳原子将居于正方体的中心,黑球表示已有1个氢原子居于该正方体的一角,请在图上画另外3个黑球标出其他3个氢原子的位置.
分析 (1)在“可燃冰”晶体中,每8个笼由46个H2O分子构成框架,其中容纳6个CH4分子和2个H2O分子,可判断每8个笼共48个H2O分子和6个CH4分子,据此推断可表示可燃冰的平均组成的化学式.
(2)分子间存在分子间作用力,形成分子晶体;
(3)由无水醋酸钠与碱石灰共热可得到甲烷,反应的化学反应方程式为:CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+CH4↑,反应的实质为脱羧反应,以此解答.
(4)甲烷分子中,碳原子和氢原子构成正四面体结构.
解答 解:(1)晶体中8个笼只有6个容纳CH4分子,另外2个笼被水分子填充,推出8个笼共有6个甲烷分子,46+2=48个水分子,则甲烷分子与水分子的个数之比=6:48=1:8,所以化学式为CH4•8H2O,
故答案为:B.
(2)“冰甲烷”中的水分子与甲烷分子以分子间作用力结合在一起,形成分子晶体;
故答案为:分子间作用力;分子;
(3)由无水醋酸钠与碱石灰共热可得到甲烷,反应的化学反应方程式为:CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+CH4↑,
则对比该反应,无水苯乙酸钠与碱石灰共热时,苯乙酸钠脱去羧基,应生成甲苯,
故选B.
(4)甲烷中的碳原子和氢原子构成正四面体结构,碳原子和氢原子的位置关系如下所示: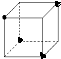 ,
,
故答案为: .
.
点评 本题考查复杂化学式的确定、有机物的结构与性质,正确理解题给信息并利用信息解答是解本题关键,侧重考查学生获取知识、运用知识解答问题能力,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4.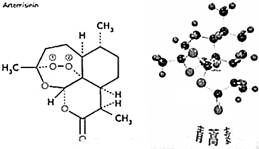 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素易溶于水 | ||
| C. | 1mol 青蒿素不能发生还原反应 | D. | 青蒿素中碳原子共有三种杂化方式 |
5.向含amol NaOH的溶液中通入bmol CO2,溶液中产生Na2CO3的物质的量为( )
①bmol ②amol ③0 ④(a-b)mol ⑤(a+b)mol.
①bmol ②amol ③0 ④(a-b)mol ⑤(a+b)mol.
| A. | ①⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④ |
2.利用下列反应不能制得较为纯净的括号中的物质的是( )
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 乙炔先加一分子HCl,再加H2(氯乙烷) | |
| C. | Cl2和苯用FeCl3作催化剂(氯苯) | |
| D. | 等物质的量的Cl2和C2H6在光照条件下(氯乙烷) |
5.实验室以氯化铁腐蚀印刷电路铜板后的溶液(简称“腐蚀废液”)为主要原料来制备氯化铁晶体,从而重新用作腐蚀印刷电路铜板的试剂.该制备流程如图: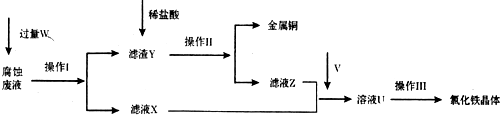
请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+ (填离子符号)先沉淀,Ksp[Mg(OH)2]>Ksp[Fe(OH)2](填“>”、“=”或“<”).

请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Cu2+ | Fe2+ | Mg2+ |
| pH | 5.2 | 7.6 | 10.4 |
12.现有部分元素的性质与原子(或分子)结构如表所示:
(1)写出元素T的原子结构示意图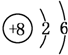 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
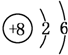 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
 .
.