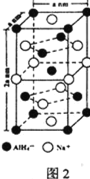
题目内容
【题目】热化学:(1)已知:C(s)+H2O(l)=CO(g)+H2(g) ΔH1=a kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH2=bkJ·moL-1;
2H2(g)+O2(g)=2H2O(l) ΔH3=ckJ·moL-1;
则C(s)+O2(g)=CO2(g) ΔH=___(用a、b、c表示)kJ·moL-1。
(2)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热ΔH=___。
化学键 | C—H | C—F | H—F | F—F |
键能(kJ·mol-1) | 414 | 489 | 565 | 155 |
【答案】![]() (2a+b+c) -1940 kJ·mol-1
(2a+b+c) -1940 kJ·mol-1
【解析】
(1)根据盖斯定律分析计算;
(2)ΔH=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量。
(1)C(s)+H2O(l)=CO(g)+H2(g) ΔH1=a kJ·mol-1 ①;
2CO(g)+O2(g)=2CO2(g) ΔH2=bkJ·moL-1 ②;
2H2(g)+O2(g)=2H2O(l) ΔH3=ckJ·moL-1 ③;
则根据盖斯定律可知,![]() (①
(①![]() 2+②+③)得到C(s)+O2(g)=CO2(g),因此ΔH=
2+②+③)得到C(s)+O2(g)=CO2(g),因此ΔH=![]() (2ΔH1+ΔH2+ΔH3)=
(2ΔH1+ΔH2+ΔH3)=![]() (2a+b+c) kJ·moL-1,故答案为:
(2a+b+c) kJ·moL-1,故答案为:![]() (2a+b+c);
(2a+b+c);
(2)结合表格数据,根据反应CH4(g)+4F2(g)=CF4(g)+4HF(g)可知,ΔH=4![]() 414 kJ·mol-1+4
414 kJ·mol-1+4![]() 155 kJ·mol-1-4
155 kJ·mol-1-4![]() 489 kJ·mol-1-4
489 kJ·mol-1-4![]() 565 kJ·mol-1=-1940 kJ·mol-1,故答案为:-1940 kJ·mol-1。
565 kJ·mol-1=-1940 kJ·mol-1,故答案为:-1940 kJ·mol-1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目