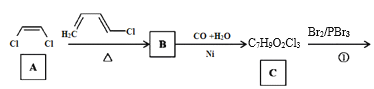
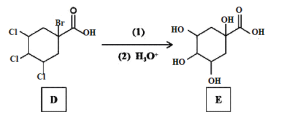
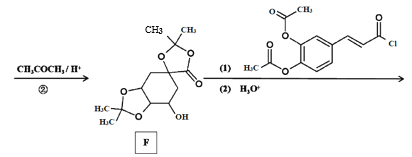
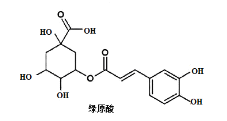
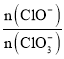题目内容
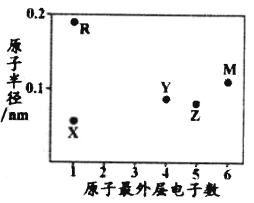
【题目】有五种短周期主族元素 X、 Y、 Z、 R、 Q, 它们的原子序数逐渐增大; 在周期表中的相对位置如图所示,Z是组成叶绿素的金属元素。下列说法错误的是
![]()
A.工业上都用电解法制Z、R单质
B.X和Y 的单质熔点: X<Y
C.Z、R、Y 的简单离子半径: Y>Z>R
D.Y和Q的最高价氧化物对应水化物酸性:Y>Q
【答案】B
【解析】
短周期元素为前三周期的元素,第一周期只有2种元素,根据五种元素所占的的位置,可确定为X、Y为第二周期,Z、R、Q为第三周期,Z是组成叶绿素的金属元素,且为短周期则为Mg;R为Al;Q为P;X为C;Y为N;
A.Mg、Al为活泼金属,工业制取时都采用电解法制取,A正确;
B.C常温下为固体,氮气常温下为气体,C的熔点高于氮气,B错误;
C.Mg、Al、N简单离子具有相同的核外电子排布,原子序数越大,半径越小,Y>Z>R,C正确;
D.N、P为同主族元素,非金属性:N>P,非金属性越强,其最高价氧化物对应的水化物的酸性越强,即Y>Q,D正确;
答案为B

练习册系列答案
相关题目