题目内容
【题目】乙烯是重要的化工原料,目前主要通过石油炼化制备。随着化石燃料资源日益减少,科研工作者正在探索和研发制备乙烯的新方法。
Ⅰ.甲烷在一定条件下脱氢可生成乙烯:2CH4(g)![]() C2H4(g)+2H2(g)△H>0
C2H4(g)+2H2(g)△H>0
(1)活化能Ea正____Ea逆(填“>”、“=”或“<”,下同);k正、k逆表示速率常数,当升高温度时,k正增大的倍数____k逆增大的倍数。
Ⅱ.利用生物无水乙醇催化脱水制备乙烯
主反应 i:C2H5OH(g)![]() C2H4(g)+H2O(g)△H1=+45.5 kJ/mol
C2H4(g)+H2O(g)△H1=+45.5 kJ/mol
副反应 ii:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g)△H2=﹣19.0 kJ/mol
C2H5OC2H5(g)+H2O(g)△H2=﹣19.0 kJ/mol
副反应 iii:C2H5OC2H5(g)![]() 2C2H4(g)+H2O(g)△H3
2C2H4(g)+H2O(g)△H3
(2)求△H3=____。
(3)在 2L 恒容密闭容器中充入2mol C2H5OH(g)和一定量的催化剂进行反应,平衡体系中含碳组分的物质的量分数随温度的变化如图所示:
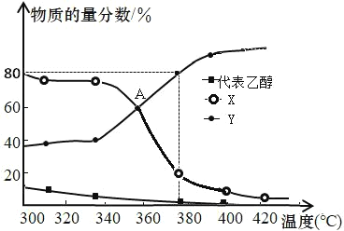
①图中 Y 代表____(填“C2H4”或“C2H5OC2H5”),请解释原因____。
②主反应 i 在 A 点达到平衡状态的标志为____。
a.乙烯浓度不再变化 b.容器内压强不随时间变化
c.混合气体的密度不随时间变化 d.△H 不再变化
③380℃时,假设乙醇完全反应,则反应 iii 的平衡常数 K=____。
【答案】> > +110kJ/mol C2H4 生成C2H4的反应为吸热反应,温度升高平衡正向移动,C2H4的物质的量分数增大 ab ![]()
【解析】
Ⅰ.(1)该反应正反应为吸热反应,正反应活化能大于逆反应活化能;温度升高,平衡正反应方向移动;
Ⅱ. (2)根据盖斯定律,主反应i×2-副反应ii可得副反应iii,据此计算△H3;
(3)①根据主反应i和副反应iii可知,生成乙烯的反应均为吸热反应,升高温度,平衡正反应方向移动,乙烯的物质的量分数增大,据此判断;
②a. 乙烯浓度不再变化,说明正逆反应速率相等;
b. 该反应为气体分子数增大的反应,压强一定,反应达到了平衡;
c. 反应前后气体总质量不变,总体积不变,混合气体的密度不变;
d. △H不再变化,不能说明反应达到了平衡;
③平衡时,设乙烯为x mol,乙醚为y mol,380![]() 时,由图像可知x=4y,乙醇完全消耗,根据碳元素守恒,n(C2H5OH)=n(C2H4)+2n(C2H5OC2H5),则x+2y=2,再根据氢元素守恒求n(H2O),最后计算
时,由图像可知x=4y,乙醇完全消耗,根据碳元素守恒,n(C2H5OH)=n(C2H4)+2n(C2H5OC2H5),则x+2y=2,再根据氢元素守恒求n(H2O),最后计算![]() 。
。
Ⅰ.(1)该反应正反应为吸热反应,活化能Ea正>Ea逆;温度升高,平衡正反应方向移动,k正增大的倍数大于k逆增大的倍数,故答案为:>;>;
Ⅱ. (2)根据盖斯定律,主反应i×2-副反应ii可得副反应iii:C2H5OC2H5(g)![]() 2C2H4(g)+H2O(g),则△H3=2△H1-△H2=45.5kJ/mol×2+19.0kJ/mol=+110kJ/mol,故答案为:+110kJ/mol;
2C2H4(g)+H2O(g),则△H3=2△H1-△H2=45.5kJ/mol×2+19.0kJ/mol=+110kJ/mol,故答案为:+110kJ/mol;
(3)①根据主反应i和副反应iii可知,生成乙烯的反应均为吸热反应,升高温度,平衡正反应方向移动,乙烯的物质的量分数增大,所以图中Y代表的是C2H4,故答案为:C2H4;生成C2H4的反应为吸热反应,温度升高平衡正向移动,C2H4的物质的量分数增大;
②a. 乙烯浓度不再变化,说明正逆反应速率相等,反应达到了平衡,a选;
b. 该反应为气体分子数增大的反应,容器内压强不随时间变化,反应达到了平衡,b选;
c. 反应过程中气体总质量始终不变,总体积不变,混合气体的密度始终不变,所以混合气体的密度不随时间变化,不能说明反应达到了平衡,c不选;
d. △H不再变化,不能说明反应达到了平衡,d错误;故答案为:ab;
③平衡时设乙烯为x mol,乙醚为y mol,380![]() 时,由图像可知x=4y,由于乙醇完全消耗,根据元素守恒,n(C2H5OH)=n(C2H4)+2n(C2H5OC2H5),则x+2y=2,解得:x=
时,由图像可知x=4y,由于乙醇完全消耗,根据元素守恒,n(C2H5OH)=n(C2H4)+2n(C2H5OC2H5),则x+2y=2,解得:x=![]() ,y=
,y=![]() ,再根据氢元素守恒,n(H2O)=
,再根据氢元素守恒,n(H2O)=![]() ,
,![]() =
=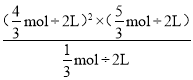 =
=![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案