题目内容
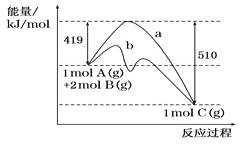
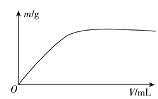
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质:向含W元素的钠盐溶液中通入x的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.W一定位于周期表中第三周期IIIA族
C.X的含氧酸的酸性可能比Z的含氧酸的酸性强
D.Z和W组成的化合物可能是离子化合物
【答案】C
【解析】
X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层,X为C元素;Y广泛作电池材料且单位质量的金属提供电子数目最多,Y为Li元素;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质,Z为Cl元素;向含W元素的钠盐溶液中通入x的氧化物,产生沉淀且不溶解,W为Al或Si元素,据此分析解答。
由上述分析可知:X为C元素;Y为Li元素;Z为Cl元素;W为Al或Si元素。
A、Li在空气中燃烧不能生成过氧化物,故A错误;
B、W为Al或Si元素,不一定位于周期表中第三周期IIIA族,故B错误;
C、X为C元素,其含氧酸可能是碳酸,Z为Cl元素,其含氧酸可能是次氯酸,碳酸的酸性强于次氯酸,故C正确;
D、Z为Cl元素,W为Al或Si元素,Z和W组成的化合物可能为四氯化碳或氯化铝,两者都是共价化合物,故D错误。
答案选C。

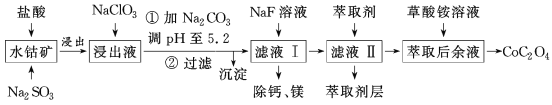
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
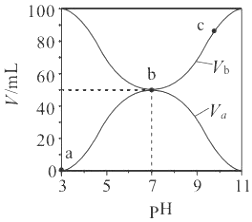
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。