题目内容
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱反应放出热量。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置进行实验。
5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置进行实验。
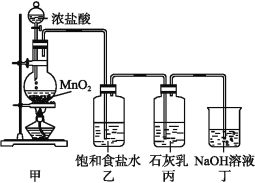
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是________。
②该兴趣小组用100 mL12 mol·L-1盐酸与8.7 g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高也是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图(不考虑氯气和水的反应)。
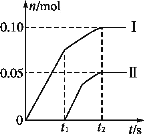
①图中曲线Ⅰ表示_______离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.35 mol,则产物中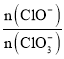 =__。
=__。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你写出一种改进方法:________。
【答案】除去氯气中的氯化氢气体 7.15 ClO- 0.25 2:1 把丙装置浸在盛有冰水的水槽中
【解析】
(1)①饱和食盐水的主要作用是除去氯气中的氯化氢气体;
②依据MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,结合定量关系计算理论值;
MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,结合定量关系计算理论值;
(2)①当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,根据温度高低来判断属于哪种离子;
②根据氧化还原反应中得失电子数相等计算氯离子的物质的量,然后根据含氯化合物中钙离子和阴离子的个数比计算氢氧化钙的物质的量;
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.35 mol,依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,结合b计算得到氢氧化钙物质的量计算氯元素物质的量,依据氧化还原反应电子守恒,生成产物中氯元素守恒列式计算。
(3)根据题中信息,在高温度下发生副反应,可以把丙装置放入冰水中。
(1)①浓盐酸和二氧化锰反应制取氯气的方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,在反应制取氯气的过程中挥发出HCl气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;
MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,在反应制取氯气的过程中挥发出HCl气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;
②n(HCl)=12 mol/L×0.1 L=1.2 mol,n(MnO2)= ![]() =0.1 mol,MnO2、HCl反应的物质的量的比是1:4,可见足量的浓盐酸与8.7 gMnO2制备氯气,以MnO2为标准计算,n(Cl2)=n(MnO2)=0.1 mol,将所得氯气与过量的石灰乳反应,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,根据方程式中物质反应关系可知:理论上最多可制得Ca(ClO)2的物质的量为0.05 mol,其质量m[Ca(ClO)2]=0.05mol×143 g/mol=7.15 g;
=0.1 mol,MnO2、HCl反应的物质的量的比是1:4,可见足量的浓盐酸与8.7 gMnO2制备氯气,以MnO2为标准计算,n(Cl2)=n(MnO2)=0.1 mol,将所得氯气与过量的石灰乳反应,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,根据方程式中物质反应关系可知:理论上最多可制得Ca(ClO)2的物质的量为0.05 mol,其质量m[Ca(ClO)2]=0.05mol×143 g/mol=7.15 g;
(2)①当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
②根据氧化还原反应中得失电子数相等计算Cl-的物质的量,设被还原的氯离子的物质的量为n,则n×1=0.10 mol×1+0.05 mol×5=0.35 mol,则反应的Cl2中含氯原子的物质的量为:0.35 mol+0.1 mol+0.05 mol=0.5 mol,在CaCl2、Ca(ClO)2、Ca(ClO3)2中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为![]() =0.25 mol;
=0.25 mol;
③取一份与②等物质的量的石灰乳,其物质的量为0.25 mol,根据氧化还原反应中得失电子数相等,生成氯离子得到电子和生成次氯酸根和氯酸根失去的电子守恒,设n(ClO-)=x,n(ClO3-)=y;则得到:0.35=x×1+y×5;依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,得到氯元素物质的量为0.5mol;x+y+0.35=0.5,解得:x=0.1 mol,y=0.05 mol,则产物中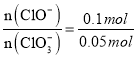 =2:1;
=2:1;
(3)由于反应在高温度下发生副反应,所以改进措施可以把丙装置放入盛有冰水的水槽中,避免发生3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。
5Cl-+ClO3-+3H2O。