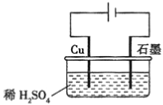
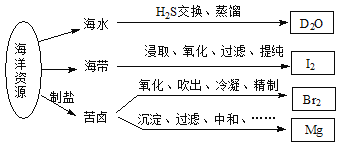
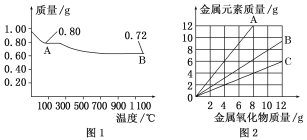
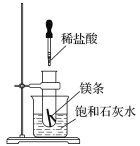
题目内容
【题目】将燃煤排放的含有SO2的烟气通入海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子)进行脱硫的工艺流程如图所示,下列说法中正确的是( )
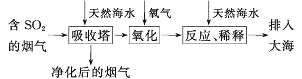
A. 天然海水显酸性
B. 氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C. 排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D. 若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
【答案】B
【解析】
A.天然海水中有CO32-、HCO3-,它们水解使海水呈弱碱性,故A错误;
B.氧化过程中可能发生的离子反应为:2SO2+2H2O+O2=4H++2SO42-,故B正确;
C.由于氧化过程中生成了硫酸,排入大海的溶液与天然海水相比,除了SO42-数量发生了变化,碳酸根、碳酸氢根离子数量也发生变化,故C错误;
D.海水中氯化钠含量最高,若将氧化后的液体进行蒸发结晶,得到的晶体中氯化钠含量最高,故D错误;
故答案为B。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目