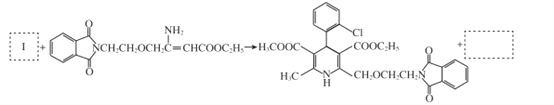
题目内容
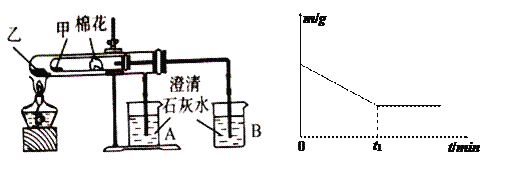
【题目】如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁条,再滴入5 mL的稀盐酸。
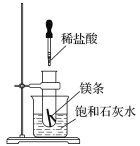
回答下列问题:
(1)实验中观察到的现象是____________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式_________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
【答案】(1)①镁片上有大量气泡产生②镁片逐渐溶解③烧杯中溶液变混浊
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体。
(3)Mg+2H+==Mg2++H2↑
(4)小于
【解析】
镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,反应物总能量高于生成物总能量的反应为放热反应,据此解答。
(1)镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,饱和石灰水中会有氢氧化钙沉淀析出,所以看到的现象为:镁片上有大量气泡产生;镁片逐渐溶解;烧杯中析出晶体;
(2)根据以上分析可知产生该现象的原因是镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
(3)镁与盐酸反应生成氯化镁和氢气,离子方程式为Mg+2H+=Mg2++H2↑;
(4)反应物总能量高于生成物总能量的反应为放热反应,镁与盐酸反应产生氢气,该反应为放热反应,所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案