题目内容
9.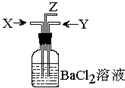 碳跟浓硫酸共热产生的气体X和二氧化锰跟浓盐酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是…( )
碳跟浓硫酸共热产生的气体X和二氧化锰跟浓盐酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是…( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 在Z导管出来的气体中无二氧化碳 | |
| C. | 洗气瓶中产生的沉淀是硫酸钡 | |
| D. | 洗气瓶中产生的沉淀是碳酸钡和亚硫酸钡 |
分析 碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,二氧化锰跟浓盐酸反应产生的气体Y是Cl2,同时通入时因Cl2与水和SO2共同作用要产生SO42-,硫酸根离子与钡离子结合生成硫酸钡沉淀,以此解答该题.
解答 解:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,二氧化锰跟浓盐酸反应产生的气体Y是Cl2,洗气瓶中发生SO2+2H2O+Cl2=H2SO4+2HCl,
A.氯化钡与硫酸反应生成硫酸钡沉淀,则洗气瓶中产生的是硫酸钡沉淀,故A错误;
B.酸性溶液抑制二氧化碳的溶解,则Z处逸出的气体中有CO2,故B错误;
C.洗气瓶中产生的沉淀是硫酸钡,故C正确;
D.碳酸钡与盐酸反应,不能生成碳酸钡沉淀,故D错误;
故选C.
点评 本题考查化学实验方案的评价及实验装置的应用,为高频考点,把握物质的性质、气体的制备及氧化还原反应原理等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列各组物质互为同系物的是( )
| A. | O2,O3 | B. | ${\;}_{6}^{13}$C,${\;}_{6}^{12}$C | C. | 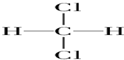 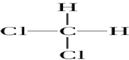 | D. | CH3CH3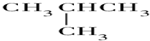 |
20.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中.
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | ||
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | |
| 乙酸乙酯(乙酸) |
17.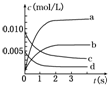 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第 5s时,SO2的转化率为65%;
(2)如图所示,表示SO3变化曲线的是b,用O2表示从0s~2s内该反应的平均速率:v=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是bc.
a.v(SO3)=2v(O2)
b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(4)若上述条件下该反应的△H=-190kJ•mo1-1,若要得到380kJ热量,则加入各物质的物质的量可能是BD.
A.4mo1SO2和2mol O2
B.6mol SO2和6mo1O2
C.4mol SO2和4mo1O2
D.6mo1SO2和4mo1O2.
 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示SO3变化曲线的是b,用O2表示从0s~2s内该反应的平均速率:v=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是bc.
a.v(SO3)=2v(O2)
b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(4)若上述条件下该反应的△H=-190kJ•mo1-1,若要得到380kJ热量,则加入各物质的物质的量可能是BD.
A.4mo1SO2和2mol O2
B.6mol SO2和6mo1O2
C.4mol SO2和4mo1O2
D.6mo1SO2和4mo1O2.
4.下列醇既能发生消去反应,又能被氧化为醛的是( )
| A. | CH3OH | B. |  | C. |  | D. |  |
14.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物 M2Y.下列说法正确的是( )
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 | |
| C. | YX2与M2Y的水溶液在酸性条件下不能反应 | |
| D. | Z元素最高价氧化物对应的水化物的化学式为HZO4 |
1. 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )| A. | 点c处正反应速率和逆反应速率相等 | |
| B. | 点a处的正反应速率比点b处的大 | |
| C. | 点d(t1时)和点e(t2时)处n(N2)不同 | |
| D. | 在t2时,正反应速率大于逆反应 |
18.下列各组元素中,原子半径依次增大的是( )
| A. | Al、Si、P | B. | I、Br、Cl | C. | Na、Mg、Al | D. | O、S、Na |
19.常温下向稀硫酸中加入铜片,无现象,向溶液中继续加入下列物质(温度不改变),铜片溶解,并有气泡产生,则该物质为( )
| A. | FeCl3 | B. | 浓硫酸 | C. | NaCl | D. | NaNO3 |