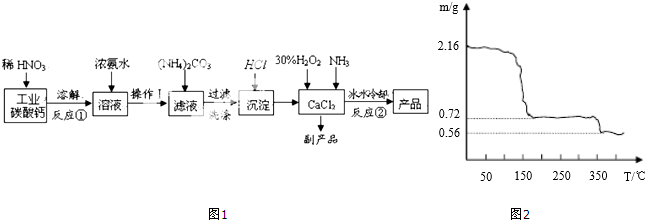
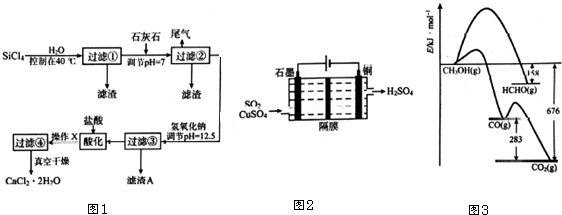
题目内容
11.下列反应的离子方程式正确的是( )| A. | 氢氧化钡溶液与硫酸反应 Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钡溶于稀盐酸中 BaCO3+2H+=Ba2++H2O+CO2↑ |
分析 A.不符合离子的配比;
B.氢氧化钙完全电离;
C.电子、电荷不守恒;
D.反应生成氯化钡、水、二氧化碳,碳酸钡、水、二氧化碳在离子反应中保留化学式.
解答 解:A.氢氧化钡溶液与硫酸反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.澄清的石灰水与稀盐酸反应的离子反应为OH-+H+=H2O,故B错误;
C.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+=Cu2++2Ag,故C错误;
D.碳酸钡溶于稀盐酸中的离子反应为BaCO3+2H+=Ba2++H2O+CO2↑,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应与置换反应的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
2.下列关于氧化还原反应的说法正确的是( )
| A. | 氧化还原反应的实质是电子的得失 | |
| B. | 氧化还原反应中得、失电子的总数一定相等 | |
| C. | 有单质参加的反应一定是氧化还原反应 | |
| D. | 氧化还原反应中一定有氧原子的得到与失去 |
19.下列叙述正确的是( )
| A. | 每个能级最多可容纳的电子数是2n2 | |
| B. | 在同一原子中没有运动状态完全相同的电子 | |
| C. | 同一能层中的不同能级的能量高低相同 | |
| D. | 不同能层中的s能级的能量高低相同 |
16.根据电子排布的特点,Co(钴)在周期表属于( )
| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |
3.下列离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| B. | 氯化钡溶液中滴加硫酸钠:Ba2++SO42-=BaSO4↓ | |
| C. | 稀盐酸滴在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| D. | 锌片投入硫酸铜溶液:Zn+CuSO4=ZnSO4+Cu |
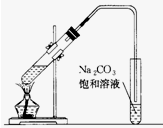 如图是实验室制乙酸乙酯的装置.在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合,然后轻轻地振荡试管,使之混合均匀.
如图是实验室制乙酸乙酯的装置.在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合,然后轻轻地振荡试管,使之混合均匀.