题目内容
2.下列关于氧化还原反应的说法正确的是( )| A. | 氧化还原反应的实质是电子的得失 | |
| B. | 氧化还原反应中得、失电子的总数一定相等 | |
| C. | 有单质参加的反应一定是氧化还原反应 | |
| D. | 氧化还原反应中一定有氧原子的得到与失去 |
分析 A.氧化还原反应的特征为化合价变化,其实质为电子转移;
B.氧化还原反应遵循电子守恒;
C.有单质参加的反应,不一定存在元素的化合价变化;
D.氧化还原反应中,不一定有氧元素参加反应.
解答 解:A.氧化还原反应的特征为化合价变化,则氧化还原反应的实质是电子的得失,故A正确;
B.氧化还原反应遵循电子守恒,即得、失电子的总数一定相等,故B正确;
C.有单质参加的反应,不一定存在元素的化合价变化,如氧气与臭氧的转化中,没有元素的化合价变化,为非氧化还原反应,故C错误;
D.氧化还原反应中,不一定有氧元素参加反应,如氢气与氯气反应生成HCl为氧化还原反应,故D错误;
故选AB.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应基本概念及常见的氧化还原反应为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.

练习册系列答案
相关题目
12.下列各组物质既不是同系物,也不是同分异构体,但最简式相同是( )
| A. | 1,2-二溴乙烷和1,1-二氯丙烷 | B. | 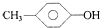 和 和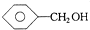 | ||
| C. | CH3CH2CH2COOH和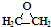 | D. | 丙炔和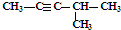 |
10.将某溶液逐滴加入到Fe(OH)3胶体内,开始出现沉淀,继续滴加时沉淀又溶解,该溶液是( )
| A. | 2mol/LH2SO4溶液 | B. | 2mol/LNaOH溶液 | ||
| C. | 2mol/LMgSO4溶液 | D. | 硅酸溶胶(胶体粒子带负电荷) |
17.下列说法不正确的是( )
| A. | 一定温度和压强下,气态物质的体积主要由构成气体的分子的大小决定 | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为4mol/L | |
| C. | 同温同压下,30mLA2气体和10mL B2气体恰好完全反应生成20mLC气体,则C化学式为 A3 B或B A3 | |
| D. | 同温同压下任何气体的分子间距离几乎相等 |
14.下列叙述中错误的是( )
| A. | 相同体积的任何气体都含有相同数目的分子 | |
| B. | 标准状况下,5L H2S气体与5L NH3的原子个数比为3:4. | |
| C. | 同温同压下相同体积的N2气和CO气体有相同物质的量、相同的质量和相同的对空气的密度 | |
| D. | 相同温度下,气体的压强比等于气体体积的反比 |
11.下列反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液与硫酸反应 Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钡溶于稀盐酸中 BaCO3+2H+=Ba2++H2O+CO2↑ |
15.下列物质属于含有共价键的离子化合物的是( )
| A. | Na2O | B. | NaOH | C. | BaCl2 | D. | CH4 |
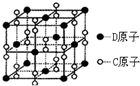 已知A、B、C、D、E都是元素周期表中的前36号元素,它们的原子序数依次增大.B原子基态时P原子轨道上有3个未成对电子,其最高正价与最低负价代数和为2,C的价层电子排布式为ns2npn+2,其氢化物是同族元素所形成的氢化物中沸点最大.化合物AC2为非极性分子,D元素的原子核外共有20种不同运动状态的电子.E是元素周期表第四周期第9列元素.请回答:
已知A、B、C、D、E都是元素周期表中的前36号元素,它们的原子序数依次增大.B原子基态时P原子轨道上有3个未成对电子,其最高正价与最低负价代数和为2,C的价层电子排布式为ns2npn+2,其氢化物是同族元素所形成的氢化物中沸点最大.化合物AC2为非极性分子,D元素的原子核外共有20种不同运动状态的电子.E是元素周期表第四周期第9列元素.请回答: