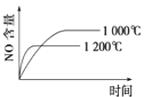
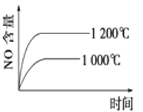
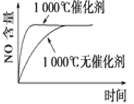
题目内容
【题目】以铬酸钾![]() 为原料,用电化学法制备重铬酸钾
为原料,用电化学法制备重铬酸钾![]() 的实验装置如图,其反应原理可表示为4K2CrO4+4H2O
的实验装置如图,其反应原理可表示为4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑,下列说法中正确的是( )
2K2Cr2O7+4KOH+2H2↑+O2↑,下列说法中正确的是( )

A.在阴极室,随着反应的进行溶液的pH逐渐变小
B.不锈钢电极上生成![]() ,惰性电极上得到
,惰性电极上得到![]()
C.惰性电极发生的电极反应为![]()
D.不锈钢应连接直流电源的正极
【答案】C
【解析】
左侧电解质为氢氧化钾,总反应有氢氧化钾生成,所以左侧为阴极室,右侧为阳极室。
A、电解时溶液中氢离子在阴极放电,阴极反应式是![]() ,则阴极室氢氧根离子浓度增大,pH增大,故A错误;
,则阴极室氢氧根离子浓度增大,pH增大,故A错误;
B、不锈钢为阴极,阴极上氢离子得电子生成氢气,惰性电极上氢氧根离子失电子生成氧气,故B错误;
C、惰性电极上氢氧根离子失电子生成氧气,则其电极方程式为:![]() ,故C正确;
,故C正确;
D、不锈钢为阴极,与直流电源的负极相连,故D错误;
故选C。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目