题目内容
【题目】25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HA溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法不正确的是
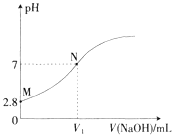
A. V1<20
B. Ka(HA)的数量级为10-5
C. M点溶液加少量水稀释,![]() 增大
增大
D. N点后,随着NaOH溶液的加入,溶液中水的电离程度逐渐增大
【答案】D
【解析】A. 0.100mol·L-1的NaOH溶液pH=2.8说明HA是弱酸,若V1=20mL则酸碱完全中和得到盐溶液,NaA为强碱弱酸盐溶液应该呈碱性,故pH=7时应该碱不足,V1<20,选项正确;B. Ka(HA)=![]() =
=![]() 10-4.8,数量级为10-5,选项B正确;C. M点溶液加少量水稀释,酸的电离程度增大,氢离子浓度增大的量比A-的多,
10-4.8,数量级为10-5,选项B正确;C. M点溶液加少量水稀释,酸的电离程度增大,氢离子浓度增大的量比A-的多,![]() 增大,选项C正确;D. N点后,随着NaOH溶液的加入,到氢氧化钠加入体积为20mL时才完全中和,溶液中水的电离程度逐渐增大,当氢氧化钠溶液过量后,碱抑制水的电离,水的电离程度又逐渐减小,选项D不正确。答案选D。
增大,选项C正确;D. N点后,随着NaOH溶液的加入,到氢氧化钠加入体积为20mL时才完全中和,溶液中水的电离程度逐渐增大,当氢氧化钠溶液过量后,碱抑制水的电离,水的电离程度又逐渐减小,选项D不正确。答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象 |
ⅰ.光照后,产生白雾,混合气体颜色变浅 ⅱ.试管内液面上升至试管的2/3;试管壁和液面上出现少量油状液滴 |

下列说法不正确的是
A. 饱和食盐水可以减少氯气的溶解
B. 油状液滴的主要成分是一氯甲烷
C. 产生白雾以及试管内液面上升证明有氯化氢生成
D. 为了探究反应条件,可用黑色纸套套住装满甲烷和氯气的试管,一段时间后进行观察