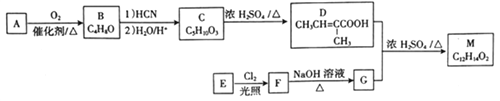
题目内容
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一.
(1)化学反应中有能量变化的本质原因是反应过程中有的断裂和形成.
(2)已知拆开1molH﹣H键、1molCl﹣Cl键、1molH﹣Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应 H2(g)+Cl2(g)=2HCl (g)的△H= .
(3)已知:CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJ/mol CH3OH(l)+
O2(g)═CO2(g)△H=﹣283.0kJ/mol CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(4)已知25℃、101kPa下,稀的强酸与稀的强碱溶液反应的中和热为﹣57.3kJ/mol. ①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为;
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、 .
【答案】
(1)化学键
(2)﹣185kJ/mol
(3)CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJ?mol﹣1
(4)![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;温度计
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;温度计
【解析】解:(1)化学反应的本质是化学键的断裂与形成,化学反应中能量变化的微观表现是断开化学键吸收的能量与形成化学键放出的能量不相等,若为若为放热反应,断开化学键吸收的能量小于形成化学键放出的能量,若为吸热反应,断开化学键吸收的能量大于形成化学键放出的能量,所以答案是:化学键;(2)已知拆开1molH﹣H键、1molCl﹣Cl键、1molH﹣Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应:H2(g)+Cl2(g)=2HCl(g)的△H=436kJ+243kJ﹣2×432kJ=﹣185KJ/mol;
所以答案是:﹣185kJ/mol;(3)①CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0kJmol﹣1
②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
依据盖斯定律②﹣①得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJmol﹣1 ;
所以答案是:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJmol﹣1 ;(4)①依据中和热概念分析,稀硫酸与稀烧碱溶液中和反应的热化学方程式为: ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3 kJ/mol;
Na2SO4(aq)+H2O(l)△H=﹣57.3 kJ/mol;
所以答案是: ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3 kJ/mol;
Na2SO4(aq)+H2O(l)△H=﹣57.3 kJ/mol;
②依据量热计的结果和原理分析,测定中和热实验时所需的玻璃仪器有烧杯、量筒、温度计、环形玻璃搅拌棒;
所以答案是:温度计.
【考点精析】通过灵活运用反应热和焓变,掌握在化学反应中放出或吸收的热量,通常叫反应热即可以解答此题.