题目内容
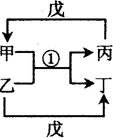
Ⅰ.有关物质存在如图所示的转化关系(部分产物已省略)。通常B为黑色粉末,C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。

请回答下列问题:
(1)反应①的化学方程式为________________________________;
(2)反应②的离子方程式为________________________________ ;
(3)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。浓度为0.01mo1/L的D溶液与a mo1/L的Pb(NO3)2溶液等体积混合,则生成沉淀所需a的最小值为____________;
(4)电解F的溶液可以实现电能转化为化学能,请写出惰性电极电解足量的F溶液的离子方程式________________________________。
Ⅱ.辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是___________,当1mol O2发生反应时,还原剂所失电子的物质的量为______mol。向CuSO4溶液中加入镁条时有气体生成,该气体是____________。

请回答下列问题:
(1)反应①的化学方程式为________________________________;
(2)反应②的离子方程式为________________________________ ;
(3)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。浓度为0.01mo1/L的D溶液与a mo1/L的Pb(NO3)2溶液等体积混合,则生成沉淀所需a的最小值为____________;
(4)电解F的溶液可以实现电能转化为化学能,请写出惰性电极电解足量的F溶液的离子方程式________________________________。
Ⅱ.辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是___________,当1mol O2发生反应时,还原剂所失电子的物质的量为______mol。向CuSO4溶液中加入镁条时有气体生成,该气体是____________。
Ⅰ(1) MnO2 + 4HCl(浓) MnCl2 + H2O + Cl2↑ (2) 6I-+ClO3-+6H+=3I2+Cl-+3H2O
MnCl2 + H2O + Cl2↑ (2) 6I-+ClO3-+6H+=3I2+Cl-+3H2O
(3)5.6×10-4 (4) 2Cl-+ 2H2O 2OH- + H2↑ + Cl2↑
2OH- + H2↑ + Cl2↑
Ⅱ.Cu2S; 4; 氢气
 MnCl2 + H2O + Cl2↑ (2) 6I-+ClO3-+6H+=3I2+Cl-+3H2O
MnCl2 + H2O + Cl2↑ (2) 6I-+ClO3-+6H+=3I2+Cl-+3H2O(3)5.6×10-4 (4) 2Cl-+ 2H2O
 2OH- + H2↑ + Cl2↑
2OH- + H2↑ + Cl2↑Ⅱ.Cu2S; 4; 氢气
试题分析:G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。
沉淀应为碘化铅PbO2,Ksp=碘离子浓度的平方乘以铅离子浓度,混合后碘离子浓度为0.005mo1/L,根据此式计算得Pb(NO3)2的物质的量浓度为5.6 × 10-4 mo1/L
(4)2Cl-+ 2H2O
 2OH- + H2↑ + Cl2↑
2OH- + H2↑ + Cl2↑
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目