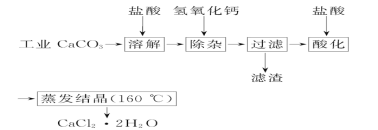
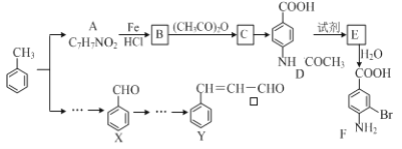
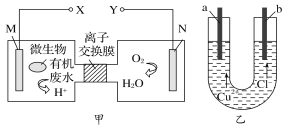
题目内容
【题目】已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液_______(填“显酸性”“显碱性”“显中性”或“酸碱性无法确定”),原因是_________________________________________________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是__________(填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) ![]() Ca2+(aq)+A2-(aq) ΔH>0。
Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp_________(填“增大”“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)_________,原因是_____________________ (用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:__________________________________________________。
【答案】酸碱性无法确定 不能确定HA-的电离程度和水解程度的大小 BC 增大 增大 加盐酸发生反应:A2-+H+![]() HA- A2-浓度减小 CaA的溶解平衡向右移动 n(Ca2+)显著增大 。而溶液体积变化不大所以c(Ca2+)增大 CaA(s)+Cu2+(aq)
HA- A2-浓度减小 CaA的溶解平衡向右移动 n(Ca2+)显著增大 。而溶液体积变化不大所以c(Ca2+)增大 CaA(s)+Cu2+(aq) ![]() Ca2+(aq)+CuA(s)
Ca2+(aq)+CuA(s)
【解析】
(1) NaHA溶液中存在HA-的电离平衡和水解平衡,HA-电离呈酸性、HA-水解呈碱性;(2) A.温度不确定,所以水的离子积常数不能确定;B.根据电荷守恒c(Na+)+c(K+)+ c(H+) =c(HA-)+2c(A2-)+ c(OH-);0.1 mol·L-1的NaHA溶液中与0.1 mol·L-1KOH溶液等体积混合时,溶质是Na2A、K2A,此时溶液呈碱性,所以向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性时,NaHA的物质的量大于KOH; 0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液,根据物料守恒分析c(Na+)+c(K+);(3) ① CaA(s) ![]() Ca2+(aq)+A2-(aq) ΔH>0,升高温度平衡正向移动,离子浓度增大;②滴加少量浓盐酸,H+与A2-生成HA-,A2-浓度减小, CaA(s)
Ca2+(aq)+A2-(aq) ΔH>0,升高温度平衡正向移动,离子浓度增大;②滴加少量浓盐酸,H+与A2-生成HA-,A2-浓度减小, CaA(s) ![]() Ca2+(aq)+A2-(aq)平衡正向移动;(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质CuA,发生沉淀转化。
Ca2+(aq)+A2-(aq)平衡正向移动;(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质CuA,发生沉淀转化。
(1) NaHA溶液中存在HA-的电离平衡和水解平衡,HA-电离呈酸性、HA-水解呈碱性,由于不能确定HA-的电离程度和水解程度的大小,所以溶液酸碱性无法确定;(2)A.温度不确定,所以水的离子积常数不能确定,所以某温度下,c(H+)·c(OH-)不一定等于1×10-14,故不选A;B.根据电荷守恒c(Na+)+c(K+)+ c(H+) =c(HA-)+2c(A2-)+ c(OH-),溶液呈中性c(H+)=c(OH-),所以c(Na+)+c(K+)=c(HA-)+2c(A2-),故选B;向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性时,NaHA的物质的量大于KOH,所以c(Na+)>c(K+),故选C;V1L 0.1 mol·L-1的NaHA溶液中滴入V2L 0.1 mol·L-1KOH溶液,根据物料守恒,c(Na+)+c(K+)=![]() mol·L-1,故不选D;(3) ① CaA(s)
mol·L-1,故不选D;(3) ① CaA(s) ![]() Ca2+(aq)+A2-(aq) ΔH>0,升高温度平衡正向移动,离子浓度增大,所以温度升高时Ksp增大;②滴加少量浓盐酸,H+与A2-生成HA-,A2-浓度减小, CaA(s)
Ca2+(aq)+A2-(aq) ΔH>0,升高温度平衡正向移动,离子浓度增大,所以温度升高时Ksp增大;②滴加少量浓盐酸,H+与A2-生成HA-,A2-浓度减小, CaA(s) ![]() Ca2+(aq)+A2-(aq)平衡正向移动,所以c(Ca2+)增大;(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质CuA,发生沉淀转化,反应离子方程式是CaA(s)+Cu2+(aq)
Ca2+(aq)+A2-(aq)平衡正向移动,所以c(Ca2+)增大;(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质CuA,发生沉淀转化,反应离子方程式是CaA(s)+Cu2+(aq)![]() Ca2+(aq)+CuA(s)。
Ca2+(aq)+CuA(s)。