题目内容
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
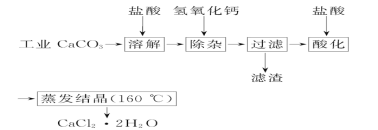
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3 是否沉淀完全的试验操作是_________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③________________________。
(3)测定样品中Cl-含量的方法是:a.称取0.750 0 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.050 00 mol· L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需要溶液润洗的仪器有_______________________________。
②计算上述样品中CaCl2·2H2O的质量分数为________________。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因是________________________;______________________。
【答案】取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3沉淀完全 防止溶液吸收空气中CO2 酸式滴定管 99.9% 样品中存在少量的NaCl 有少量的CaCl2·2H2O失水
【解析】
(1)根据Fe3+遇SCN-变红色分析;(2)Ca(OH)2易吸收空气中的CO2,生成CaCO3沉淀;(3) ①滴定操作时,滴定管需要用待盛液润洗, AgNO3溶液呈酸性,盛在酸式滴定管中。②根据关系式CaCl2·2H2O~~ 2AgNO3计算上述样品中CaCl2·2H2O的质量分数。③样品中氯元素质量分数偏大,测定的样品中CaCl2·2H2O的质量分数偏高。
(1) Fe3+遇SCN-变红色,检验Fe(OH)3 是否沉淀完全的试验操作是:取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3沉淀完全;
(2) 由于Ca(OH)2易吸收空气中的CO2,生成CaCO3沉淀,所以加入盐酸,调节溶液的pH约为4.0可以防止溶液吸收空气中CO2;
(3) ①滴定操作时,滴定管需要用待盛液润洗, AgNO3溶液呈酸性,盛在酸式滴定管中。测定过程中需要溶液润洗的仪器有酸式滴定管;
②设CaCl2·2H2O的质量为xg
CaCl2·2H2O~~ 2AgNO3
147g 2mol
Xg 0.050 00 mol· L-1![]() 0.02039 L
0.02039 L
![]()
X=0.0749g
CaCl2·2H2O的质量分数为![]() ;
;
③样品中存在少量的NaCl或有少量的CaCl2·2H2O失水,都会造成氯元素质量分数偏大,测定的样品中CaCl2·2H2O的质量分数偏高。









