题目内容
1.已知在25℃、1.013×105Pa条件下,1molH2在氧气中完全燃烧后放出286KJ热量,1mol水蒸气转化为液态水放出热量为44KJ.其他的相关数据如下表:| 物质 | H2(g) | O2(g) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | 496 | a |
| A. | 463 | B. | 260 | C. | 926 | D. | 970 |
分析 根据盖斯定律计算反应2H2(g)+O2(g)=2H2O(l)的△H,结合反应热等于反应物的总键能减生成物的总键能列方程计算.
解答 解:在25℃、1.013×105Pa条件下,1molH2在氧气中完全燃烧后放出286KJ热量,即热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-286×2kJ/mol,又1mol水蒸气转化为液态水放出热量为44KJ,所以2H2(g)+O2(g)=2H2O(g)△H=-286×2+88=-484kJ/mol,反应热等于反应物的总键能减生成物的总键能,则-484=2×436+496-2a,a=926,
故选C.
点评 本题考查反应热的计算,题目难度不大,注意反应热与键能的计算关系以及物质的不同聚集状态的转化.

练习册系列答案
相关题目
12.绿色化学的核心就是利用化学原理从源头上减少和 消除工业生产对环境的污染.下列转化符合绿色化学原则,且原子利用率为100%的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl+HCl | B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | ||
| C. | CH2=CH2+Br2$\stackrel{一定条件}{→}$CH2BrCH2Br | D. | 3NO2+H2O═2HNO3+NO |
9.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见右表.回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:3Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-.则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见右表.回答下列问题:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:3Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-.则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).
16.下列变化过程中肯定要放出热量的是( )
| A. | H2→H+H | B. | H+Cl→HCl | ||
| C. | C(石墨)→C(金刚石) | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2 |
6.下列反应不属于取代反应的是( )
| A. | CH2=CH2+H2$\stackrel{催化剂}{→}$C2H6 | |
| B. | 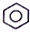 +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$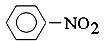 +H2O +H2O | |
| C. | CH3COOCH2CH3+H2O$→_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
10.下列说法正确的是( )
| A. | 乙烯能与高锰酸钾发生取代反应而使酸性高锰酸钾溶液褪色 | |
| B. | 苯能与高锰酸钾发生取代反应而使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯能与溴单质发生加成反应而使溴水褪色 | |
| D. | 苯能与溴单质发生加成反应而使溴水褪色 |
11.某水溶液只可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-和SO42-.现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液后加热,收集到标准状况下的气体896mL;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推测不正确的是( )
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液后加热,收集到标准状况下的气体896mL;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推测不正确的是( )
| A. | 不-定存在K+ | B. | 100mL溶液中含有0.02molCO32- | ||
| C. | 可能存在Cl- | D. | 一定不存在Mg2+ |
 ⑪
⑪ ⑫
⑫