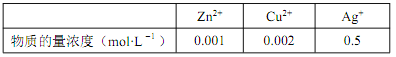
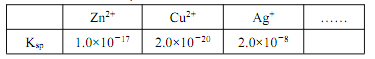题目内容
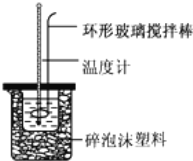
【题目】实验室用50mL0.50molL-1盐酸、50mL0.55molL-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 23.9 |
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 _________________ .
(2)在操作正确的前提下,提高中和热测定准确性的关键是 ______ .大烧杯如不盖硬纸板,求得的中和热数值将 ______ (填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在 ______ 中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= ________
[盐酸和NaOH溶液的密度按1gcm-3计算,反应后混合溶液的比热容(c)按4.18J(g℃)-1计算].
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 ______ (填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL0.55molL-1的NaOH溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”或“不相等”),所求中和热 ______ (填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是 __________ .
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
【答案】铜丝是热的良导体,传热快,热量损失大提高装置的保温效果偏小保温瓶(保温杯)-56.8 kJ/mol偏大不相等相等ABDF
【解析】
(1)不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体,故答案为:Cu传热快,热量损失大;
(2)在中和反应中,必须确保热量不散失,应提高装置的保温效果;大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;在日常生活实际该实验在保温杯中效果更好;故答案为:提高装置的保温效果;偏小;保温杯;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应前后温度差为:3.45℃;第2次实验盐酸和NaOH溶液起始平均温度为20.40℃,反应前后温度差为:3.40℃;第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应前后温度差为:3.35℃;三次温度差的平均值为3.40℃,50mL0.50molL-1盐酸、50mL0.55molL-1NaOH溶液的质量m=100mL×1g/mL=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.40℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为![]() =56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:-56.8kJ/mol;
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:-56.8kJ/mol;
(4)氢氧化钠固体溶于水,放出热量,所以实验中测得的“中和热”数值将偏大;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL0.5mol/L的盐酸与50mL0.55molL-1的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关,测得中和热数值相等,故答案为:偏大,不相等,相等;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故B正确;C、做本实验的室温和反应热的数据之间无关,故C错误;D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,弱碱电离要吸热,导致实验测得中和热的数值偏小,故D正确;E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱完全反应,导致实验测得中和热的数值偏高,故E错误;F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,导致实验测得中和热的数值偏小,故F正确;故选:ABDF。

【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
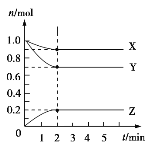
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。