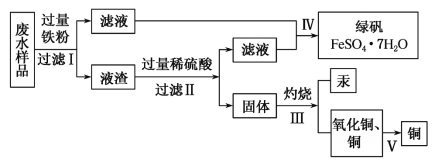
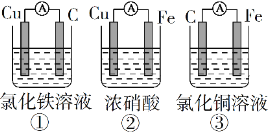
题目内容
【题目】_____P4 +_____HClO3 +_____H2O —_____HCl +_____H3PO4
【答案】3 10 18 10 12
【解析】
P4中P的化合价从0升高到+5,1molP4共失去4×5mol=20mol电子,HClO3中的Cl的化合价从+5降低到-1,得到6mol电子,得失电子守恒,最小公倍数为60,P4的系数为60÷20=3,HClO3的系数为60÷6=10,根据原子守恒,HCl的系数为10,H3PO4的系数为12,再根据H守恒,可得H2O的系数为18,化学方程式为3P4+10HClO3+18H2O =10HCl+12H3PO4。

【题目】Ⅰ.可逆反应3A(g)![]() 3B(?)+C(?) ΔH>0达到化学平衡后,
3B(?)+C(?) ΔH>0达到化学平衡后,
(1)升高温度,用“变大” “变小” “不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量________;
②若B、C都不是气体,气体的平均相对分子质量________;
③若B是气体,C不是气体,气体的平均相对分子质量________;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的50%,则B是________态,C是________态。
Ⅱ.某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)![]() CH3OH(g),测定的部分实验数据如表所示:
CH3OH(g),测定的部分实验数据如表所示:
t(s) | 0 | 500 | 1 000 |
c(H2)( mol·L-1) | 5.00 | 3.52 | 2.48 |
c(CO)( mol·L-1) | 2.50 |
(1)在500 s内用H2表示的化学反应速率是__________________。
(2)在1 000 s内用CO表示的化学反应速率是___________________,1000 s时CO的转化率是________。
(3)在500 s时生成的甲醇(CH3OH)的浓度是_______________________。
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
【题目】实验室用50mL0.50molL-1盐酸、50mL0.55molL-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 23.9 |
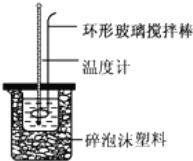
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 _________________ .
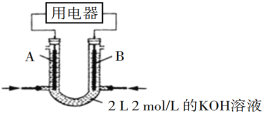
(2)在操作正确的前提下,提高中和热测定准确性的关键是 ______ .大烧杯如不盖硬纸板,求得的中和热数值将 ______ (填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在 ______ 中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= ________
[盐酸和NaOH溶液的密度按1gcm-3计算,反应后混合溶液的比热容(c)按4.18J(g℃)-1计算].
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 ______ (填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL0.55molL-1的NaOH溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”或“不相等”),所求中和热 ______ (填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是 __________ .
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.