题目内容
【题目】已知:Al、Fe、Cu 的合金与稀硝酸反应生成的气体只有 NO,实验过程如下:
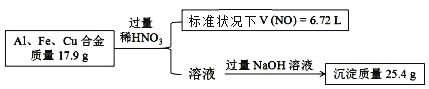
另取等量该合金,溶于足量 NaOH (aq),则可得气体的物质的量是
A. 0.22 mol B. 0.15 mol C. 0.3 mol D. 无法计算
【答案】B
【解析】
Al、Fe、Cu 均可与稀硝酸反应,生成V(NO)=6.72L,则 n(NO)=0.3mol,反应中电子转移0.3mol×3=0.9mol。加入过量NaOH溶液,生成沉淀为氢氧化铁和氢氧化铜,再利用电子守恒结合质量守恒计算。
由标况下 V(NO)=6.72L,则 n(NO)=0.3mol,可知该合金与稀硝酸反应时失去电子0.3mol*3=0.9mol,由合金与过量稀硝酸反应的溶液与过量氢氧化钠溶液反应生成成沉淀 25.4 g,可知生成的沉淀为氢氧化铁和氢氧化铜混合物,且质量和为 25.4 g,由电子得失守恒和质量守恒进行求算。设生成氢气的物质的量为 xmol,则合金中铝的物质的量为 2x /3 mol,可列出算式:合金中铁和铜的质量和为(17.9—2x*27 /3)g=(17.9-18x)g,25.4 g沉淀中铁元素和铜元素质量和为 25.4-(0.9-2x)*17=(10.1+34x)g,由 17.9-18x=10.1+34x,解得 x= 0.15 ,故正确答案 B。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目