题目内容
【题目】四种短周期元素 X、Y、Z 和 W 在元素周期表中的位置如图所示,原子序数之和为 48。下列有关说法中正确的是
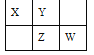
A. 原子半径(r)大小比较 r(X)< r(Y)
B. Z 和 Y 可形成共价化合物 YZ3
C. W 的非金属性比 Z 的强,所以 W 的简单气态氢化物的沸点比 Z 的高
D. W 的最低价单核阴离子的失电子能力比 X 的弱
【答案】D
【解析】
由短周期元素X、Y、Z 和 W 在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,设X原子序数为a,则Y原子序数为a+1,Z原子序数为a+9,W原子序数为a+10,则a+a+1+a+9+a+10=48,a=7,故X为N元素, Y为O元素, Z为S元素, W为Cl元素。
由位置及原子序数之和为 48 可推得 X、Y、Z 和 W 分别是 N、O、S和Cl;
A.同周期元素原子半径由左向右依次减小,原子半径(r)大小比较 r(X)>r(Y),A错误;
B.Z 和 Y 可形成共价化合物为 SO3 ,即应为 ZY3,B错误;
C.Cl 的非金属性比 S 的强,但非金属性与气态氢化物的沸点高低无关,C错误;
D.非金属性W>X,故W的最低价单核阴离子(Cl-)的失电子能力比 X 的(N3-)弱,D正确,故选 D。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目