题目内容
17.Ⅰ.A与SO2属于等电子体(即具有相同的原子总数和相同的最外层电子总数的微粒),常温下是一种无色的气体,当冷却到77K时,变成橙红色液体.A的一种制备方法是:在真空中,将CuO和硫一起混合加热,可生成A,同时生成一种黑色固体B.(1)写出上述制备A的化学反应方程式CuO+3S$\frac{\underline{\;\;△\;\;}}{\;}$ S2O+CuS.
(2)若将S2Cl2与CuO在100~400℃加热时也能生成A.写出相应的化学反应方程式S2Cl2+CuO $\frac{\underline{\;100℃-400℃\;}}{\;}$S2O+CuCl2
(3)A也能在水中发生歧化反应,生成两种常见的酸(但酸性都不强).则这两种酸由强到弱的化学式分别为H2SO3和H2S.
Ⅱ.A是有机羧酸盐HCOONa,B、C、D是常见化合物;A、B、C、D焰色反应均呈黄色,水溶液均呈碱性,其中B的碱性最强.X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同.C受热分解得到Y、D和X;B与C反应生成D和X.E由两种元素组成,相对分子质量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g•L-1.
(1)E晶体中含有的化学键是离子键
(2)X的沸点比同主族同类型物质要高,原因是水分子间存在氢键
(3)写出E与X反应的化学方程式Na3N+3H2O=3NaOH+NH3.
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式2Na++CO32-+H2O+CO2=2NaHCO3↓.B与C反应生成D和X的离子方程式HCO3-+OH-=CO32-+H2O.
分析 Ⅰ.(1)A与SO2属于等电子体,将CuO和硫一起混合加热,可生成A,同时生成一种黑色固体B,分析元素组成,硫和氧化铜反应生成黑色固体是铜的化合物,判断为CuS,结合原子守恒和电子守恒配平化学方程式;
(2)将S2Cl2与CuO在100~400℃加热时也能生成A,依据(1)的判断A为S2O,结合原子守恒配平化学方程式;
(3)A也能在水中发生歧化反应,生成两种常见的酸(但酸性都不强),说明是硫元素化合价升高和降低,升高为+4价,降低为-2价,对应酸为亚硫酸和氢硫酸;
Ⅱ.A是有机羧酸盐HCOONa,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2中的一种,由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3,即2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O,故X为H2O,Y为CO2.E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g•L-1,可知气体Z的相对分子质量=0.76×22.4=17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,可确定E是Na3N.
(1)分析判断E是Na3N,属于离子化合物;
(2)水分子间形成氢键,增大物质溶沸点;
(3)E与X反应生成氢氧化钠和氨气;
(4)D为Na2CO3,其饱和溶液中不断通入CO2,析出C为NaHCO3,B与C反应生成D和是碳酸氢钠与氢氧化钠反应生成碳酸钠与水;
解答 解:Ⅰ.(1)A与SO2属于等电子体,常温下是一种无色的气体,当冷却到77K时,变成橙红色液体.A的一种制备方法是:在真空中,将CuO和硫一起混合加热,可生成A,同时生成一种黑色固体B,分析组成元素生成的黑色固体只能为CuS,原子守恒配平得到化学方程式为:CuO+3S$\frac{\underline{\;\;△\;\;}}{\;}$ S2O+CuS;
故答案为:CuO+3S$\frac{\underline{\;\;△\;\;}}{\;}$ S2O+CuS;
(2)将S2Cl2与CuO在100~400℃加热时也能生成S2O,硫元素、氧元素化合价不变,则发生的不是氧化还原反应,反应生成S2O和CuCl2,反应的化学方程式为:S2Cl2+CuO $\frac{\underline{\;100℃-400℃\;}}{\;}$S2O+CuCl2;
故答案为:S2Cl2+CuO $\frac{\underline{\;100℃-400℃\;}}{\;}$S2O+CuCl2;
(3)S2O也能在水中发生歧化反应,生成两种常见的酸(但酸性都不强),说明是硫元素化合价升高和降低,升高为+4价,降低为-2价,对应酸为亚硫酸和氢硫酸,这两种酸由强到弱的化学式分别H2SO3,H2S;
故答案为:H2SO3,H2S;
Ⅱ.A是有机羧酸盐HCOONa,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2中的一种,由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3,即2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O,故X为H2O,Y为CO2.E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g•L-1,可知气体Z的相对分子质量=0.76×22.4=17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,可确定E是Na3N.
(1)上述分析可知E为Na3N,属于离子化合物含有离子键,故答案为:离子键;
(2)X为H2O,水分子之间存在氢键,沸点高于同主族同类型物质,故答案为:水分子之间存在氢键;
(3)E与X反应生成氢氧化钠和氨气,反应的化学方程式为:Na3N+3H2O=3NaOH+NH3↑;
故答案为:Na3N+3H2O=3NaOH+NH3↑;
(4)D为Na2CO3,其饱和溶液中不断通入CO2,析出C为NaHCO3,反应的离子方程式为:2Na++CO32-+H2O+CO2=2NaHCO3↓;
B与C反应生成D和是碳酸氢钠与氢氧化钠反应生成碳酸钠与水,离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓;HCO3-+OH-=CO32-+H2O.
点评 本题考查无机物推断,是对学生综合能力的考查,充分利用题目信息进行推断,物质性质和结构分析是关键,题目难度较大.

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 结构式 | B. | 电子式 | C. | 球棍模型 | D. | 比例模型 |
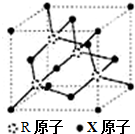 X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等. 2C(g)ΔH<0,下列图象正确的是
2C(g)ΔH<0,下列图象正确的是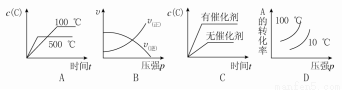
 可以被KMnO4的酸性溶液氧化生成
可以被KMnO4的酸性溶液氧化生成  ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到  .
.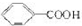 的异构体共有7种,其中的3种是
的异构体共有7种,其中的3种是 CH2CH2CH2CH2,
CH2CH2CH2CH2,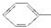 CH(CH2)CH2CH2CH2,
CH(CH2)CH2CH2CH2, CH2CH(CH2)CH2CH2
CH2CH(CH2)CH2CH2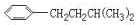 、
、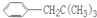 、
、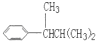 、
、 .
.

 常压下,1molSO2的体积为22.4L
常压下,1molSO2的体积为22.4L