题目内容
2.如下图装置工作一段时间后,电解质溶液的成分及浓度均未改变的是( )| A. |  | B. | 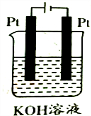 | C. |  | D. | 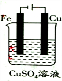 |
分析 A、没有外接电源的属于原电池,负极为锌失电子生成锌离子进入溶液,正极上铜离子放电析出铜单质;
B、有外接电源的属于电解池,阳极上氢氧根离子放电,阴极上氢离子放电,据此分析;
C、有外接电源的属于电解池,阳极上氯离子放电,阴极上氢离子放电,据此分析;
D、有外接电源的属于电解池,又属于电镀池,阳极上铜失电子,阴极上铜离子得电子,据此分析.
解答 解:A、没有外接电源的属于原电池,负极为锌失电子生成锌离子进入溶液,正极上铜离子放电析出铜单质,导致电解质溶液发生变化,故A错误;
B、有外接电源的属于电解池,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解水导致溶液中溶液的体积减小,溶质的物质的量不变,则浓度增大,故B错误;
C、有外接电源的属于电解池,阳极上氯离子放电,阴极上氢离子放电,实际上是电解HCl,所以溶液中溶质的物质的量减小,浓度也减小,故C错误;
D、有外接电源的属于电解池,又属于电镀池,阳极上铜失电子,阴极上铜离子得电子,所以溶液中溶质的物质的量不变,浓度也不变,故D正确;
故选D.
点评 本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,难度中等.

练习册系列答案
相关题目
15.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,下列叙述正确的是( )
| A. | 原子序数:A>B>D>C | B. | 金属性B>D,非金属性A>C | ||
| C. | 原子半径:D>B>C>A | D. | 简单离子半径:C>B>D>A |
13.空气是人类生存所必需的重要资源,下列说法正确的是( )
| A. | 2009年11月,中国政府公布了温室气体减排的行动目标,减排气体是的指二氧化硫 | |
| B. | 氮氧化物排放会引起光化学污染而与酸雨无关 | |
| C. | 开发新能源、燃煤脱硫、安装汽车尾气转化器等措施可以减少酸雨 | |
| D. | 二氧化碳是无毒的气体,可以任意排放 |
10.(有机物体的表示方法、有机物的相互反应和同分异构体)观察下列模型,其中只有C、H、O三种原子,下列说法错误的是( )
| 序号 | 1 | 2 | 3 | 4 |
| 模型示意图 |  |  |  |  |
| A. | 模型1对应的物质的二氯代物有2种 | |
| B. | 模型2对应的物质的官能团是羧基 | |
| C. | 模型2对应的物质可与模型3对应的物质发生酯化反应 | |
| D. | 模型4对应的物质可以与氯气发生加成反应 |
 HClO:
HClO:
 Na2O2:
Na2O2: .
.
 aHA溶液中各种离子浓度由大到小的顺序是。
aHA溶液中各种离子浓度由大到小的顺序是。