题目内容
9.在1L的密闭容器中发生反应N2O4?2NO2,已达平衡状态①若此时为标准状况下(273K 101kPa),再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色A(和原平衡状态比,填选项字母,下同)
A.增大(加深) B.减小(变浅) C.不变 D.不能确定
②若此时为25℃,101kPa下,再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色A,混合物中NO2的体积分数A.
A.增大(加深) B.减小(变浅) C.不变 D.不能确定.
分析 N2O4?2NO2该反应正反应是气体体积增大的反应,正反应为吸热反应,平衡正向移动时,混合气体颜色加深,据此分析.
解答 解:①平衡时再向其中加入4.6g纯的NO2,平衡虽然逆向移动,但二氧化氮浓度增大,混合气体颜色变深,故答案为:A;
②温度升至25℃,平衡正向移动,向其中加入4.6g纯的NO2,平衡虽然逆向移动,但二氧化氮浓度增大,混合气体颜色变深,故答案为:A;A.
点评 本题考查了影响平衡移动的因素,注意温度和浓度对平衡移动的影响,题目难度不大.

练习册系列答案
相关题目
2.下列各变化中属于原电池反应的是( )
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 锌与稀硫酸反应时,加入少量NaHSO4固体时,可使反应速率加快 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 镀锌铁表面有划损时,仍然能阻止铁被氧化 |
 HClO:
HClO:
 Na2O2:
Na2O2: .
.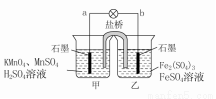
 移向甲烧杯
移向甲烧杯
 表示阿伏加德罗常数)
表示阿伏加德罗常数)