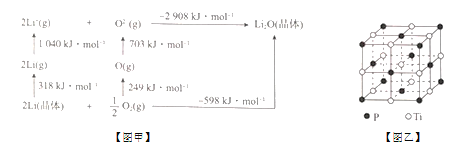
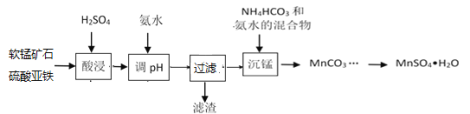
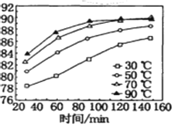
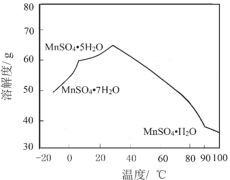
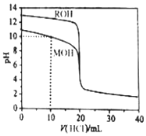
��Ŀ����
����Ŀ���±���25��ʱ����ĵ���ƽ�ⳣ��������˵����ȷ����
CH3COOH | HClO | H2CO3 |
Ka=1.8��10��5 | Ka=3.0��10��8 | Ka1=4.1��10��7 Ka2=5.6��10��11 |
A.���ݱ������ݿ�֪����ͬŨ��CH3COONa��NaClO�Ļ����Һ�У���������Ũ�ȵĴ�С��ϵ�ǣ�c(Na+)��c(ClO��)��c(CH3COO��)��c(OH��)��c(H+)
B.���ݱ������ݿ�֪������������Һ��ͨ������CO2�����ӷ���ʽΪ��2ClO��+CO2+H2O=CO32��+2HClO
C.��0.1mol��L-1CH3COOH��Һ�м�������ˮ����Һ��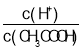 ��С
��С
D.�����£���̼������Һ������70������Һ���е�OH����Ŀ����
���𰸡�D
��������
A. ���ݱ������ݿ�֪����ͬŨ��CH3COONa��NaClO�Ļ����Һ�У�NaClO��ˮ��̶Ƚϴ����������Ũ�ȵĴ�С��ϵ�ǣ�c(Na+)��c(CH3COO��)��c(ClO��)��c(OH��)��c(H+)��A����
B. ���ݱ������ݿ�֪���ԣ�HClO> HCO3��������������Һ��ͨ������CO2�����ӷ���ʽΪ��ClO��+CO2+H2O= HCO3��+HClO��B����
C. ��0.1mol��L-1CH3COOH��Һ�м�������ˮ�����������ƽ��������У���c(CH3COOH)��С�ij̶ȴ���c(H+)����Һ��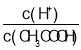 ����C����
����C����
D. �����£���̼������Һ������70�����¶����ߣ�̼���Ƶ�ˮ��ƽ��������У���Һ���е�OH-��Ŀ���࣬D��ȷ��
��ΪD��

����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����2KMnO4 + 5H2C2O4 + 3H2SO4��K2SO4 + 2MnSO4 + 10CO2�� + 8H2O
��ʵ�����ݼ���¼��
ʵ���� | �����£��Թ��������Լ���������/mL | ��������Һ��ɫ������ɫ����ʱ��/min | |||
0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05mol/L KMnO4��Һ | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
��ش�
��1�������ϱ��е�ʵ�����ݣ����Եõ��Ľ�����__________________��
��2����С��ͬѧ���ݾ��������n(Mn2+)��ʱ��仯���Ƶ�ʾ��ͼ����ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n(Mn2+) ��ʱ��仯������Ӧ��ͼ2��ʾ����С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����

��С��ͬѧ����ļ�����___________________________________________________��
��3����Ѫ�Ƶĺ���ʱ����������ʵ�飺
�ٿɽ�4mLѪҺ������ˮϡ�ͺ������м������������(NH4)2C2O4���壬��Ӧ����CaC2O4��������������ϡ���ᴦ����H2C2O4��Һ��
�ڽ��ٵõ���H2C2O4��Һ����������KMnO4��Һ�ζ�����������ΪCO2����ԭ����ΪMn2+��
���յ�ʱ��ȥ20mL l.0��l0-4mol/L��KMnO4��Һ��
�ζ��յ��������_________________________________��
�����в����ᵼ�²ⶨ���ƫ�͵���______��
A����ƿ�ô��������Һ��ϴ
B���ζ������У���ƿҡ����̫���ң���ƿ����Һ�ν���
C����ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��յ�ʱ��������
D���ﵽ�ζ��յ�ʱ�����Ӷ���
���㣺ѪҺ�к������ӵ�Ũ��Ϊ______mol/L��