题目内容
【题目】设NA代表阿佛加德罗常数,下列说法错误的是 ( )
A.12g C60中含有6NA个电子
B.1mol HNO3见光分解,转移电子数4NA
C.46g NO2和46g N2O4含有的原子数均为3NA
D.60g SiO2与足量纯碱反应,高温下最多可释放出NA个气体分子
【答案】B
【解析】
A.C60由碳原子构成,12gC60中含有的碳原子的物质的量n=![]() =1mol,每个C原子有6个电子,所以12g C60中含有6NA个电子,故A正确;
=1mol,每个C原子有6个电子,所以12g C60中含有6NA个电子,故A正确;
B.硝酸见光分解的方程式:4HNO3![]() 4NO2↑+O2↑+2H2O可知,4mol硝酸分解转移4mol电子,即1mol硝酸转移1mol电子,故B错误;
4NO2↑+O2↑+2H2O可知,4mol硝酸分解转移4mol电子,即1mol硝酸转移1mol电子,故B错误;
C.NO2和N2O4的最简式均为NO2,故46gNO2和46gN2O4的中含有的NO2的物质的量为1mol,故含3NA个原子,故C正确;
D.60gSiO2的物质的量为1mol,根据反应方程式Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,1mol二氧化硅完全反应可以生成1mol二氧化碳,最多可释放出二氧化碳气体的分子数为NA,故D正确;
Na2SiO3+CO2↑可知,1mol二氧化硅完全反应可以生成1mol二氧化碳,最多可释放出二氧化碳气体的分子数为NA,故D正确;
故答案为B。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】下表是25℃时弱酸的电离平衡常数,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10—5 | Ka=3.0×10—8 | Ka1=4.1×10—7 Ka2=5.6×10—11 |
A.根据表中数据可知,相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.根据表中数据可知,次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO﹣+CO2+H2O=CO32﹣+2HClO
C.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中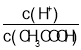 减小
减小
D.室温下,将碳酸钠溶液加热至70℃,溶液的中的OH—数目增多