题目内容
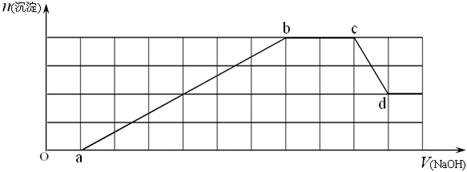
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是( )
| A.K+一定存在 | B.混合溶液中c(CO32-)为1 mol/L |
| C.Cl-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
C
解析试题分析:(1)第一份加入AgNO3溶液有沉淀生成,可能存在、Cl-、CO32-、SO42-中的至少一种;(2)第二份加足量NaOH溶液后,收集到气体0.05mol;则含有NH4+,其物质的量是n(NH4+)="0.05mol;" (3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。则n(SO42-)= 2.33g÷233g/mol=0.01mol;n(CO32-)= (4.3g-2.33g)÷197g/mol=0.01mol。c(CO32-)为="0.01mol" ÷0.1L="0.1" mol/L。根据离子Mg2+、CO32-会发生沉淀反应而不能电离共存;Ba2+、SO42-也会发生沉淀反应而不能电离共存;可知一定不含Mg2+、Ba2+,根据溶液呈电中性,CO32-、SO42-,带的负电荷总数是0.02mol×2="0.04mol;" NH4+带的正电荷总数是0.05mol×1=0.05mol;正电荷总数大于负电荷总数,所以一定含有阴离子Cl-。因此正确的选项是C。
考点:考查溶液中离子的检验及溶液成分的确定的知识。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案现有下列十种物质:①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | | 氧化物 | | | 电解质 |
| 属于该类的物质 | ② | | ⑧⑨ | ⑦ | |
 H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。(3)⑩在水中的电离方程式为 ,17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为 ,SO42-的物质的量浓度为 。
(4)少量的④通入⑥的溶液中反应的离子方程式为 。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是 (填化学式),还原剂与氧化剂的物质的量之比是 ,当有5.4g Al发生反应时,转移电子的物质的量为 。
该反应的离子方程式为 。
下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由于反应物的浓度不同而引起的是
| A.Fe+H2SO4 | B.Cu+HNO3 | C.NaOH+ CO2 | D.AlCl3 +NaOH |
下列离子方程式正确的是( )
| A.澄清石灰水中滴加稀硫酸:Ca(OH)2+2H+=Ca2++2H2O |
| B.实验室用大理石和稀盐酸正确CO2:2H++CO32-= CO2↑+H2O |
| C.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓。 |
| D.过量的SO2与NaOH溶液反应:SO2+OH-=HSO3- |
下列物质属于强电解质且该状态下能导电的是 ( )
(1)氯化钠溶液; (2)氯化铵固体; (3)铜; (4)石墨;(5)熔融NaOH; (6) 稀硫酸; (7)乙酸;
| A.(1)(2)(5)(6) | B.(5) | C.(2)(5) | D.(1)(3)(4)(5)(6) |
(原创)下列离子方程式错误的是
| A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| B.向KI溶液中加H2SO4溶液后振摇:4H+ + 4I-+ O2 = 2I2 + 2H2O |
| C.酸性高锰酸钾中加入草酸,溶液褪色:2MnO4- + 5H2C2O4 + 6 H+ = 2Mn2+ + 10CO2↑ +8H2O |
| D.证明C的非金属性强于Si的反应:SiO32-+ CO2+ H2O = H2SiO3↓+ CO32- |
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中: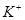 、 、 、 、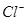 、 、 |
B.室温下, 的盐酸中: 的盐酸中: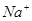 、 、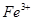 、 、 、 、 |
C.含有 的溶液中: 的溶液中: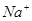 、 、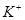 、 、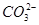 、 、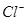 |
D.由水电离产生的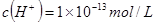 的溶液中: 的溶液中: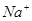 、 、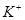 、 、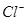 、 、 |
下列离子方程式书写正确的是
| A.醋酸与氨水反应:CH3COOH+NH3?H2O═CH3COO-+NH4+ + H2O |
| B.氯气跟水反应:Cl2+H2O=2H++Cl-+ClO- |
| C.钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| D.硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |