题目内容
下列物质属于强电解质且该状态下能导电的是 ( )
(1)氯化钠溶液; (2)氯化铵固体; (3)铜; (4)石墨;(5)熔融NaOH; (6) 稀硫酸; (7)乙酸;
| A.(1)(2)(5)(6) | B.(5) | C.(2)(5) | D.(1)(3)(4)(5)(6) |
B
解析试题分析:(1)氯化钠溶液能够导电,但是是混合物,错误;(2)氯化铵固体是电解质,但是不能导电,错误;(3)铜是金属单质,不是电解质,能够导电;错误;(4)石墨是非金属单质,不是电解质,能够导电;错误;(5)熔融NaOH是电解质,能够导电,正确;(6) 稀硫酸是混合物,不是电解质,能够导电,错误;(7)乙酸是电解质,不能导电,错误。
考点:考查物质的分类的知识。

练习册系列答案
相关题目
下列叙述中,能证明某物质是强电解质或弱电解质的是
| A.某物质熔化时不导电,则该物质为弱电解质 |
| B.某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
| C.某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
| D.溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
水溶液中能大量共存的一组离子是
| A.Na+、Ca2+、Cl-、SO42- | B.Fe2+、H+ 、SO32-、ClO- |
| C.Mg2+、NH4+、Cl-、SO42- | D.K+、Fe3+、NO3-、SCN- |
某无色透明的酸性溶液中能大量共存的一组离子是( )
| A.Mg2+、Na+、SO42-、NO 3- | B.Na+、HCO3-、K+、SO42- |
| C.MnO4-、K+、SO42-、Na+ | D.NH4+、CO32-、Al3+、Cl- |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是( )
| A.K+一定存在 | B.混合溶液中c(CO32-)为1 mol/L |
| C.Cl-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
下列离子方程式对应的化学方程式正确的是
| A.H++OH-=H2O CH3COOH+NaOH=CH3COONa+H2O |
| B.Ba2++SO42-=BaSO4↓Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| C.CO32-+2H+=CO2↑+H2O CaCO3+2HCl=CaCl2+CO2↑+H2O |
| D.3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
能正确表示下列反应的离子方程式是
| A.NaHCO3的水解:HCO3-+H2O=CO32-+H3O+ |
| B.用银氨溶液检验乙醛的醛基: CH3CHO+2Ag(NH3)2OH  CH3COO-+NH4++3NH3+2Ag↓+H2O CH3COO-+NH4++3NH3+2Ag↓+H2O |
C.向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O- 2C6H5OH+2CO32- 2C6H5OH+2CO32- |
| D.泡沫灭火剂的原理:Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
下列离子方程式与所述事实相符且正确的是( )
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.向Na2SO3溶液中通入足量氯气:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ |
| C.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-=Mn2++Cl2↑+2H2O |
| D.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+ |
 的性质___________(填序号,下同)。
的性质___________(填序号,下同)。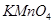 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________ B.
B.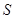 C.
C. D.
D.
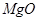 、
、 、
、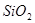 、
、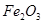 组成。其中
组成。其中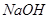 溶液至过量、过滤,滤渣中的主要成分是_________。
溶液至过量、过滤,滤渣中的主要成分是_________。