题目内容
下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由于反应物的浓度不同而引起的是
| A.Fe+H2SO4 | B.Cu+HNO3 | C.NaOH+ CO2 | D.AlCl3 +NaOH |
AB
解析试题分析:B选项铜与浓硝酸反应生成的气体是二氧化氮,与稀硝酸反应生成的气体是一氧化氮。因此B选项是正确的。D选项,氯化铝与少量氢氧化钠反应生成的是氢氧化铝沉淀,随着氢氧化钠的量增多,沉淀会溶解。因此D选项是正确的
考点:考查常见金属性质的相关知识点

练习册系列答案
相关题目
下列叙述中,能证明某物质是强电解质或弱电解质的是
| A.某物质熔化时不导电,则该物质为弱电解质 |
| B.某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
| C.某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
| D.溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4 2H2SO4 |
B.热的纯碱溶液可以清洗油污的原因: +2H2O +2H2O H2CO3+2OH¯ H2CO3+2OH¯ |
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH¯=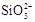 +H2O +H2O |
| D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ ClO-+2H+= Cl2↑+ H2O |
水溶液中能大量共存的一组离子是
| A.Na+、Ca2+、Cl-、SO42- | B.Fe2+、H+ 、SO32-、ClO- |
| C.Mg2+、NH4+、Cl-、SO42- | D.K+、Fe3+、NO3-、SCN- |
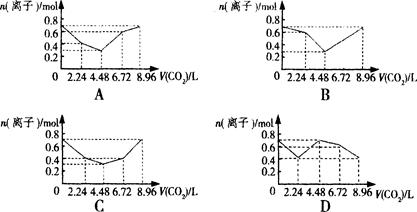
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是( )
| A.K+一定存在 | B.混合溶液中c(CO32-)为1 mol/L |
| C.Cl-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
下列表示对应化学反应的离子方程式正确的是
| A.碳酸钙溶于醋酸:CaCO3+ 2H+ = Ca2++ CO2↑+H2O |
B.苯酚钠溶液中通入少量的CO2: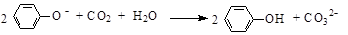 |
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O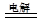 2Cu↓+O2↑+4H+ 2Cu↓+O2↑+4H+ |
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH-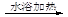 |