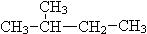题目内容
(原创)下列离子方程式错误的是
| A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| B.向KI溶液中加H2SO4溶液后振摇:4H+ + 4I-+ O2 = 2I2 + 2H2O |
| C.酸性高锰酸钾中加入草酸,溶液褪色:2MnO4- + 5H2C2O4 + 6 H+ = 2Mn2+ + 10CO2↑ +8H2O |
| D.证明C的非金属性强于Si的反应:SiO32-+ CO2+ H2O = H2SiO3↓+ CO32- |
A
解析试题分析:A、NH4HCO3溶于过量的NaOH溶液,NH4+也与OH?反应,错误;B、向KI溶液中加H2SO4溶液后振摇,在酸性条件下,I?被O2氧化,离子方程式为:4H+ + 4I-+ O2 = 2I2 + 2H2O,正确;C、酸性高锰酸钾中加入草酸,MnO4?能把H2C2O4氧化为CO2,离子方程式为:2MnO4- + 5H2C2O4 + 6 H+ = 2Mn2+ + 10CO2↑ +8H2O,正确;D、CO2、H2O与硅酸盐反应生成H2SiO3,可证明H2CO3的酸性大于H2SiO3,则C的非金属性强于Si,离子方程式为:SiO32-+ CO2+ H2O = H2SiO3↓+ CO32-,正确。
考点:本题考查离子方程式的书写。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4 2H2SO4 |
B.热的纯碱溶液可以清洗油污的原因: +2H2O +2H2O H2CO3+2OH¯ H2CO3+2OH¯ |
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH¯=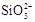 +H2O +H2O |
| D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ ClO-+2H+= Cl2↑+ H2O |
下列反应的离子方程式中正确的是
| A.氯气与水反应: Cl2 + H2O= 2H++Cl- +ClO- |
| B.氯气通入氢氧化钠溶液中:2Cl2 + 2OH- =3Cl-+ClO- +H2O |
| C.氯化亚铁溶液中滴加过量新制氯水:2Fe2+ +Cl2 = 2Fe3+ + 2Cl- |
| D.少量碳酸钙固体加入足量稀盐酸中:CO32- +2H+ = CO2↑ + H2O |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是( )
| A.K+一定存在 | B.混合溶液中c(CO32-)为1 mol/L |
| C.Cl-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.在pH=1的溶液中:K+、Na+、SO42–、HCO3- |
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO 、SO42– 、SO42– |
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH 、I-、SCN- 、I-、SCN- |
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO |
下列溶液中,一定能大量共存的离子组是
| A.能使氢氧化铝迅速溶解的溶液: Na+、Fe2+、NO3—、SO42— |
| B.能使酚酞试液变红的溶液: Na+、NH4+、 CO32—、SO42— |
| C.含有大量SO42—的透明溶液: K+ 、Cu2+ 、Cl—、NO3— |
| D.含有大量ClO—的溶液: H+、 Mg2+、I—、SO42— |
下列离子方程式正确的是
| A.向水中通入氯气:Cl2+H2O===2H++Cl-+ClO- |
| B.碳酸钠溶液中通入二氧化碳:CO32-+CO2+H2O ===2HCO3- |
| C.实验室制备氯气:MnO2+4HCl(浓)=== 2Mn2++2H2O+2Cl2↑ |
| D.稀硫酸与氢氧化钡溶液反应:H++ SO42-+Ba2++OH-=BaSO4↓+H2O |
下列反应的离子方程式正确的是( )
| A.硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH- = Cu(OH)2↓ |
| B.澄清石灰水跟盐酸反应:H++OH-= H2O |
C.NaHS水解:HS-+ H2O S2-+ H3O+ S2-+ H3O+ |
| D.Ca(HCO3)2溶液中加入少量NaOH溶液: Ca2++2HCO3-+2OH-= CaCO3↓+CO32-+2H2O |
 和
和 ;
;