题目内容
【题目】氯苯是一种重要的有机合成原料,用氯苯合成染料中间体F的两条路线如下图所示。
路线1: 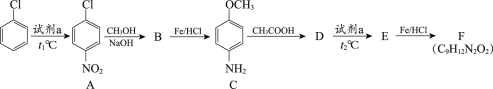
路线2: 
(1)试剂a为________。
(2)A→B的反应类型为取代反应,该反应的化学方程式为________。
(3)B→C的反应类型为________。
(4)C与CH3COOH的相对分子质量之和比D的相对分子质量大18,D→E的取代反应发生在甲氧基(—OCH3)的邻位,F的结构简式为________。
(5)G的结构简式为________。
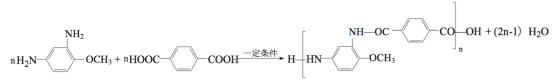
(6)有机物I与对苯二甲酸(![]() )发生聚合反应的化学方程式为_____。
)发生聚合反应的化学方程式为_____。
(7)I与CH3COOH反应生成的有机产物除F外,还可能有________(写出结构简式)。
(8)满足下列条件的C的同分异构体有________种。①与FeCl3溶液发生显色反应②分子中含有—NH2③苯环上有3种氢
【答案】浓硫酸、浓硝酸 ![]() +CH3OH+NaOH→
+CH3OH+NaOH→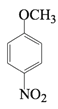 +NaCl+H2O 还原反应
+NaCl+H2O 还原反应 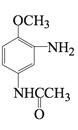
 10
10
【解析】
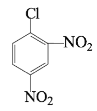
路线1:![]() 和浓硫酸、浓硝酸的混合物发生消化反应生成
和浓硫酸、浓硝酸的混合物发生消化反应生成![]() ,B发生还原反应生成
,B发生还原反应生成![]() ,则B是
,则B是![]() ;
; 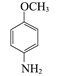 与醋酸的相对分子质量之和比D大18,说明有水生成,则D是
与醋酸的相对分子质量之和比D大18,说明有水生成,则D是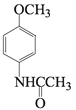 ,D与浓硫酸、浓硝酸的混合液的取代反应发生在甲氧基(—OCH3)的邻位,则E是
,D与浓硫酸、浓硝酸的混合液的取代反应发生在甲氧基(—OCH3)的邻位,则E是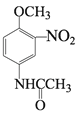 ;
; 发生还原反应生成F,则F是
发生还原反应生成F,则F是 。
。
路线2:![]() 和浓硫酸、浓硝酸的混合物发生硝化反应生成
和浓硫酸、浓硝酸的混合物发生硝化反应生成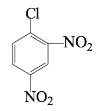 ,则G是
,则G是 ,
, 与氢氧化钠的甲醇溶液发生反应生成
与氢氧化钠的甲醇溶液发生反应生成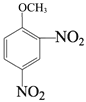 ,
, 发生还原反应生成
发生还原反应生成 ,
, 与乙酸反应生成F
与乙酸反应生成F 。
。
根据以上分析,(1)![]() 和浓硫酸、浓硝酸的混合物发生硝化反应生成
和浓硫酸、浓硝酸的混合物发生硝化反应生成![]() ,则试剂a为浓硫酸、浓硝酸。
,则试剂a为浓硫酸、浓硝酸。
(2)![]() →
→![]() 的反应是氯原子被甲氧基代替,该反应的化学方程式为
的反应是氯原子被甲氧基代替,该反应的化学方程式为![]() +CH3OH+NaOH→
+CH3OH+NaOH→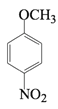 +NaCl+H2O。
+NaCl+H2O。
(3) →
→![]() 是硝基变为氨基,反应类型为还原反应。
是硝基变为氨基,反应类型为还原反应。
(4)C与CH3COOH的相对分子质量之和比D的相对分子质量大18,则D是 ,D→E的取代反应发生在甲氧基(—OCH3)的邻位,E是
,D→E的取代反应发生在甲氧基(—OCH3)的邻位,E是 ,F的结构简式为
,F的结构简式为 。
。
(5)![]() 和浓硫酸、浓硝酸的混合物发生硝化反应生成G,则G是
和浓硫酸、浓硝酸的混合物发生硝化反应生成G,则G是 。
。
(6) 与对苯二甲酸(
与对苯二甲酸(![]() )发生缩聚反应的化学方程式为
)发生缩聚反应的化学方程式为 。
。
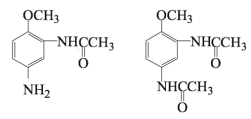
(7) 与CH3COOH反应生成的有机产物除F外,还可能是甲氧基邻位的氨基发生取代反应,也有可能是两个氨基都发生取代反应,故有
与CH3COOH反应生成的有机产物除F外,还可能是甲氧基邻位的氨基发生取代反应,也有可能是两个氨基都发生取代反应,故有 。
。
(8)①与FeCl3溶液发生显色反应②分子中含有—NH2③苯环上有3种氢, 符合条件的同分异构体,苯环上有3个取代基,分别是-OH、-NH2、-CH3,根据定一移二的原则,共有10种结构。
符合条件的同分异构体,苯环上有3个取代基,分别是-OH、-NH2、-CH3,根据定一移二的原则,共有10种结构。

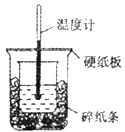
【题目】用如图所示的装置进行中和热的测定实验,分别取50 mL 0.55 mol/L的NaOH溶液、50 mL 0.25 mol/L的硫酸进行实验,回答下列问题:
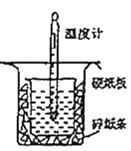
(1)从图中实验装置看,其中尚缺少的用品是_______,除此之外,装置中的一个明显错误是_______。
(2)近似认为0.55 mol/L的NaOH溶液和0.25 mol/L的硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以下数据计算中和热△H=_________。(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用50 mL0.25 mol/L的H2SO4和50 mL0.55 mol/L的NH2·H2O溶液进行反应,与上述实验相比,所放出的热量_______(填“不变”“偏高"或“偏低”)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是________(填字母)。
a. 实验装置保温、隔热效果差
b. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d. 将以上四实验测量温度均纳入计算平均值
【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
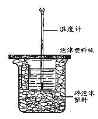
(1)图中未画出的实验器材是______________。
(2)烧杯间填满碎纸条的作用是 ___________________________。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
①试计算上述实验测出的中和热ΔH1=______________。
②如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)
③如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将____(填“偏大”、“偏小”、“不变”) , 其理由是___