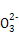题目内容
氯化铁是常见的水处理剂,无水FeCl3易升华。工业上制备无水FeCl3的一种工艺如图所示:
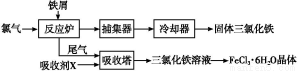
(1)加入吸收塔的吸收剂X应是 (填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5 mL饱和FeCl3溶液滴入50 mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为 。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入 且保持过量,然后进行的操作依次为 、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为 。
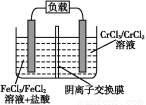
(5)铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+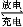 Fe2++Cr3+
Fe2++Cr3+
则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
(1)c
(2)Fe3++3H2O Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
(3)盐酸 蒸发浓缩(或加热蒸发)
(4)H2S+2Fe3+ 2Fe2++S↓+2H+
2Fe2++S↓+2H+
(5)负 Cr3++e- Cr2+
Cr2+
【解析】(1)根据流程图可知,从反应炉中排出的尾气是剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液。(3)从FeCl3溶液制得FeCl3·6H2O晶体的过程中,为抑制Fe3+的水解,需先加入盐酸且保持过量,然后依次进行蒸发浓缩、冷却结晶、过滤等操作。(4)H2S气体通入FeCl3溶液中,Fe3+将H2S氧化为S,Fe3+被还原为Fe2+。(5)电池工作时,电解质溶液中的阴离子移向负极,则铁铬氧化还原液流电池放电时,Cl-将移向负极;充电时,阴极发生还原反应,Cr3+得电子生成Cr2+,即Cr3++e- Cr2+。
Cr2+。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案已知合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | n5 |
H2 | 4.50 | 4.20 | 3.60 | n4 | n6 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
下列说法正确的是( )
A.反应3 h内,反应速率v(N2)为0.17 mol·L-1·h-1
B.此温度下,该反应的平衡常数为0.037
C.反应进行到1 h时放出的热量为9.22 kJ
D.4 h时,若再加入1 mol N2,达到新的化学平衡时,N2的转化率是原来的两倍