题目内容
【题目】生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。
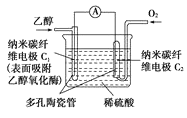
已知C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+,下列有关说法不正确的是( )
A. C1极为电池负极,C2极为电池正极
B. 电子由C2极经外电路导线流向C1极
C. C2极的电极反应式为O2+4H++4e-=2H2O
D. 该生物燃料电池的总反应式为:C2H5OH+3O2=2CO2+3H2O
【答案】B
【解析】
在乙醇燃料电池中总反应为C2H5OH+3O2=2CO2+3H2O。其中燃料被氧化,其在原电池的负极上发生氧化反应,负极反应为:C2H5OH+3H2O-12e-=2CO2+12H+;助燃剂(氧气)在正极上发生还原反应,正极反应为O2+4H++4e-=2H2O。以此解题。
A.根据题给电极反应式知,C1极为电池负极,C2极为电池正极,A项正确;
B. 电子由负极C1经外电路流向正极C2极,B项错误;
C.C2极为电池正极,电极反应式为O2+4H++4e-=2H2O,C项正确;
D. 该生物燃料电池为乙醇燃料电池,其总反应式为:C2H5OH+3O2=2CO2+3H2O,D项正确;
答案应选B。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为_____。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度______NaHCO3 (填”大于”或”小于”)。丙同学认为甲、乙的判断都不充分。
丙认为: (1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填”甲”或”乙”)判断正确。试剂X是____。
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
(2)查阅资料发现NaHCO3的分解温度为150℃,丙断言____(填”甲”或”乙”)的判断是错误的,理由是___________。