题目内容
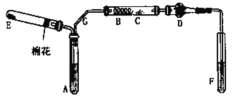
【题目】I.原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计了如图所示装置。

(1)a和b不连接时,烧杯中现象是__________________。
(2)a和b用导线连接,Cu极为原电池_____(“正”或“负”)极,电极反应式为____;溶液中H+移向_____(填“Cu”或“Zn”)极。电池总反应化学方程式为_______________。
(3)若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为_____。
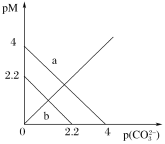
II.某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:

(1)由图中的数据分析,该反应的化学方程式为__________________。
(2)5 min内用Z表示的平均反应速率为____________。
(3)化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,这是利用________________原理加快了氢气生成的速率。
【答案】锌片逐渐溶解,锌片上有气泡冒出 正 2H++2e=H2↑ Cu Zn+H2SO4=ZnSO4+H2↑ 增加21.6g 3X+Y![]() 3Z 0.06 mol·L-1·min-1 原电池
3Z 0.06 mol·L-1·min-1 原电池
【解析】
I.a和b不连接时,锌与稀硫酸反应;a和b用导线连接,形成原电池,锌作负极、Cu作正极;若电解质溶液改为AgNO3溶液,锌作负极、Cu作正极,结合原电池原理分析解答;
II.(1)由图可知,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且5min达到平衡,根据△n(X)∶△n(Y) ∶△n(Z)计算判断方程式中各物质的化学计量数,据此书写反应的方程式;(2)结合v=![]() 计算;(3)根据影响化学反应速率的因素结合原电池原理分析解答。
计算;(3)根据影响化学反应速率的因素结合原电池原理分析解答。
I.(1)a和b不连接时,锌与稀硫酸反应,锌片逐渐溶解,锌片上有气泡冒出,故答案为:锌片逐渐溶解,锌片上有气泡冒出;
(2) a和b用导线连接,形成原电池,锌比铜活泼,锌作负极、Cu作正极,正极上氢离子放电,电极反应式为2H++2e-=H2↑,电池总反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;原电池中,电解质溶液中氢离子向正极移动,故答案为:正;2H++2e-=H2↑;Cu;Zn+H2SO4=ZnSO4+H2↑;
(3)若电解质溶液改为AgNO3溶液,锌作负极,负极的电极反应式为Zn-2e-=Zn2+,Cu作正极,正极的电极反应式为2Ag++2e-═2Ag,当转移0.2mol电子时,Cu片上析出0.2mol Ag,Cu片质量增加了0.2mol×108g/mol=21.6g,故答案为:增加21.6g;
II.(1)由图可知,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X)∶△n(Y)∶△n(Z)=0.6mol∶0.2mol∶0.6mol=3∶1∶3,且5min达到平衡,为可逆反应,则反应的化学方程式为3X+Y3Z,故答案为:3X+Y3Z;
(2)5min内用Z表示的平均反应速率为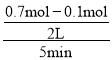 =0.06mol/(L·min),故答案为:0.06mol/(L·min)。
=0.06mol/(L·min),故答案为:0.06mol/(L·min)。
(3)实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,反应过程中粗锌中的锌和杂质碳等与稀硫酸构成原电池,加快了氢气的生成速率,故答案为:原电池。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为_____。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度______NaHCO3 (填”大于”或”小于”)。丙同学认为甲、乙的判断都不充分。
丙认为: (1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填”甲”或”乙”)判断正确。试剂X是____。
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
(2)查阅资料发现NaHCO3的分解温度为150℃,丙断言____(填”甲”或”乙”)的判断是错误的,理由是___________。