题目内容
10.溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2+2NaBr═2NaCl+Br2,该反应被氧化的元素为Br(写元素符号);若上述反应制得16g Br2,则转移的电子数目是0.2NA或1.204×1023个.分析 Cl2+2NaBr=2NaCl+Br2中,Br元素的化合价升高,生成160g溴(即1mol溴单质)转移2mol电子,据此分析.
解答 解:Cl2+2NaBr=2NaCl+Br2中,Br元素的化合价升高,则Br元素被氧化,生成160g溴转移2mol电子,反应制得16g Br2,则转移的电子数目为$\frac{16g}{160g/mol}$×2×NAmol-1=0.2NA或1.204×1023,
故答案为:Br;0.2NA或1.204×1023.
点评 本题考查氯气的性质及氧化还原反应,把握物质的性质为解答的关键,侧重氧化还原反应基本知识的考查,题目难度不大.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
20.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中.
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | ||
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | |
| 乙酸乙酯(乙酸) |
1.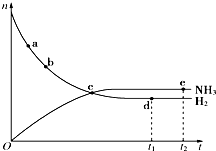 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )| A. | 点c处正反应速率和逆反应速率相等 | |
| B. | 点a处的正反应速率比点b处的大 | |
| C. | 点d(t1时)和点e(t2时)处n(N2)不同 | |
| D. | 在t2时,正反应速率大于逆反应 |
18.下列各组元素中,原子半径依次增大的是( )
| A. | Al、Si、P | B. | I、Br、Cl | C. | Na、Mg、Al | D. | O、S、Na |
5.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇和苯 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烯和乙烷 | |
| C. | 用燃烧法鉴别乙醇和苯 | |
| D. | 用碳酸钠溶液鉴别乙醇和乙醛 |
15.下列说法不正确的是( )
| A. | 醋酸可用作调味剂及防腐剂 | B. | CO2和CH4都是温室气体 | ||
| C. | 阿司匹林可用作抗酸药 | D. | 植物油可用于制备人造黄油 |
19.常温下向稀硫酸中加入铜片,无现象,向溶液中继续加入下列物质(温度不改变),铜片溶解,并有气泡产生,则该物质为( )
| A. | FeCl3 | B. | 浓硫酸 | C. | NaCl | D. | NaNO3 |
20.已知NaHSO3 溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32-②
向0.1mol/L 的NaHSO3 溶液中分别加入以下物质,下列有关说法正确的是( )
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32-②
向0.1mol/L 的NaHSO3 溶液中分别加入以下物质,下列有关说法正确的是( )
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | NaHSO3 溶液中,c(H2SO3)>c(SO32-),加水稀释后离子浓度均减小 | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$减小,$\frac{c(O{H}^{-})}{c({H}^{+})}$的值增大 | |
| D. | 加入氨水至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
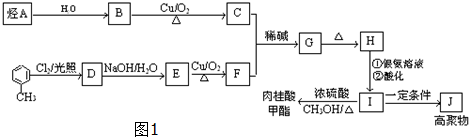

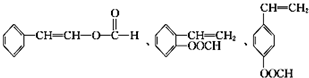
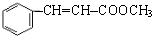 ,J的结构简式为
,J的结构简式为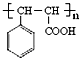 .
.
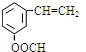 、
、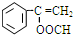 .
.