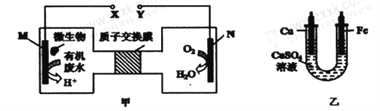
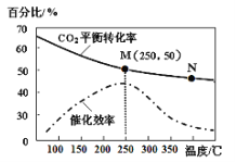
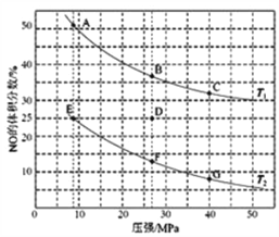
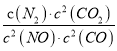题目内容
【题目】碳酸钠、碳酸氢钠与盐酸反应的比较。

(1)按上图要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的碳酸钠、碳酸氢钠粉末的小气球套在两支试管的管口。将气球内的碳酸钠和碳酸氢钠同时倒入试管中,观察到的实验现象是_________。
(2)实验结论是_____________________。
(3)碳酸钠与盐酸反应的化学方程式是____________,离子方程式是_________________。
(4)碳酸氢钠与盐酸反应的化学方程式是____________,离子方程式是__________。
【答案】两个气球均膨胀;碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气体膨胀得快且大 碳酸氢钠与盐酸反应产生气体比碳酸钠与盐酸反应产生气体多且剧烈 Na2CO3+2HCl===2NaCl+H2O+CO2↑ CO32—+2H+=CO2↑+H2O NaHCO3+HCl===NaCl+H2O+CO2↑ HCO3—+H+===CO2↑+H2O
【解析】
与相同浓度的盐酸反应时,碳酸氢钠反应速率快,等质量的碳酸钠、碳酸氢钠,碳酸氢钠的物质的量大于碳酸钠,结合反应的方程式Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑、NaHCO3 + HCl=NaCl+H2O+CO2↑分析解答。
(1)与相同浓度的盐酸反应时,碳酸氢钠反应速率快,等质量的碳酸钠、碳酸氢钠,碳酸氢钠的物质的量大于碳酸钠,根据方程式Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑、NaHCO3 + HCl=NaCl+H2O+CO2↑可知碳酸氢钠放出的二氧化碳多,因此看到的现象为两个气球均膨胀;碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气体膨胀得快且大,故答案为:两个气球均膨胀;碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气体膨胀得快且大;
(2)根据(1)的分析,实验结论为碳酸氢钠与盐酸反应产生气体比碳酸钠与盐酸反应产生气体多且剧烈,故答案为:碳酸氢钠与盐酸反应产生气体比碳酸钠与盐酸反应产生气体多且剧烈;
(3)碳酸钠与盐酸反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;CO32-+2H+=CO2↑+H2O;
(4)碳酸氢钠与盐酸反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑,离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:NaHCO3+HCl=NaCl+H2O+CO2↑;HCO3-+H+=CO2↑+H2O。