题目内容
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
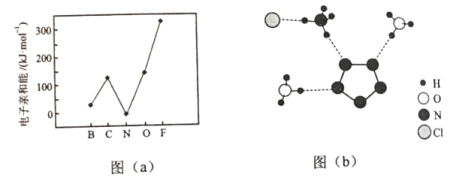
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B. 中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5—中的大π键应表示为____________。
),则N5—中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)NH…Cl、____________、____________。
(4)R的晶体密度为d g·cm3,其立方晶胞参数为a nm,晶胞中含有y个单元,该单元的相对质量为M,则y的计算表达式为______________。
【答案】![]() 同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子 ABD C 5
同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子 ABD C 5 ![]() (H3O+)O-H…N(N5-) (NH4+)N-H…N(N5-)
(H3O+)O-H…N(N5-) (NH4+)N-H…N(N5-) ![]()
【解析】
(1)氮原子价层电子为最外层电子,即2s22p3,则电子排布图为![]() ;
;
(2)元素的非金属性越强,越易得到电子,则第一电子亲和能越大,同周期从左到右核电荷数依次增大,半径逐渐减小,从左到右易结合电子,放出的能量增大;N的最外层为半充满结构,较为稳定,不易结合一个电子;答案为同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子;
(3)图示中的阳离子分别为H3O+和NH4+;
①A.阳离子为H3O+和NH4+,NH4+中心原子N形成4个σ键,孤电子对数为![]() 价层电子对数为4,杂化类型为sp3;H3O+中心原子是O,形成3σ键,孤电子对数为
价层电子对数为4,杂化类型为sp3;H3O+中心原子是O,形成3σ键,孤电子对数为![]() ,价层电子对数为4,为sp3杂化;
,价层电子对数为4,为sp3杂化;
B.由以上分析可知H3O+和NH4+中心原子的价层电子对数都为4;
C.NH4+为空间构型为正四面体,H3O+为空间构型为三角锥形;
D.含有的共价键类型都为σ键。
两种阳离子的相同之处为ABD,不同之处为C;
②根据图(b)N5-中σ键总数为5个;根据图示,每个N原子和周边的N原子形成2个键,则每个N原子还有1个2P轨道没有成键。可知5个N原子,共有5个2p轨道,形成一个大π键,该大π键含有5+1个=6电子,可用符号![]() 表示;
表示;
③O、N的非金属性较强,对应的O-H、N-H都可与N形成氢键,根据图示,氢键还有2种,可表示为(H3O+)O-H…N(N5-)、(NH4+)N-H…N(N5-);
(4)由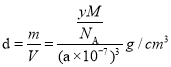 ,NA=6.02×1023mol-1,带入数据,得
,NA=6.02×1023mol-1,带入数据,得![]() 。
。