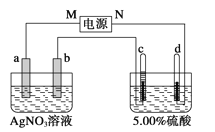
题目内容
【题目】室温下,向0.01 mol·L1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如右图所示。下列分析正确的是
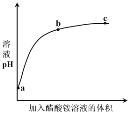
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,溶液pH增大是CH3COOH![]() H+ + CH3COO-逆向移动的结果
H+ + CH3COO-逆向移动的结果
【答案】B
【解析】
试题分析:A.醋酸是弱酸,0.01 mol·L1的醋酸溶液的pH > 2,故A错误;B.b点为醋酸和醋酸铵的混合溶液,溶液显酸性,pH逐渐接近7,根据电荷守恒,c(CH3COO-) + c(OH-)= c(NH4+)+ c(H+),因此c(CH3COO-) > c(NH4+),故B正确;C.酸性溶液和中性溶液混合,不可能变成碱性,故C错误;D.ac段,相当于醋酸溶液的稀释,稀释过程中,CH3COOH![]() H+ + CH3COO-正向移动,但c(H+)减小,故D错误;故选B。
H+ + CH3COO-正向移动,但c(H+)减小,故D错误;故选B。

练习册系列答案
相关题目