题目内容
(1)用Al2(SO4)3制取Al(OH)3,常用氨水与Al2(SO4)3反应,而不用NaOH(aq),是什么原因? ________________________________________________________________。
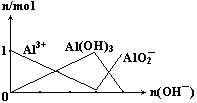
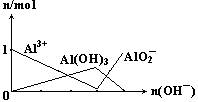
(2)AlCl3与NaOH溶液反应,当Al3+与OH-的物质的量之比为________时沉淀最多,________时沉淀全部溶解,________时沉淀为最多时的一半。
(3)现代科学实验证明,溶液中不存在,应为[Al(OH)-4],是沿用旧的书写习惯。请写出Al2(SO4)3溶液与过量NaOH溶液反应的化学方程式(不能用偏铝酸盐表示):______________________。
(2)AlCl3与NaOH溶液反应,当Al3+与OH-的物质的量之比为________时沉淀最多,________时沉淀全部溶解,________时沉淀为最多时的一半。
(3)现代科学实验证明,溶液中不存在,应为[Al(OH)-4],是沿用旧的书写习惯。请写出Al2(SO4)3溶液与过量NaOH溶液反应的化学方程式(不能用偏铝酸盐表示):______________________。
(1)氨水是弱碱,NaOH是强碱,过量的氨水不能溶解Al(OH)3,而过量的NaOH能溶解Al(OH)3。故实验室中制取Al(OH)3用氨水而不用NaOH
(2)1∶3 1∶4 2∶3或2∶7
(3)Al2(SO4)3+8NaOH══2Na[Al(OH)4]+3Na2SO4
(2)1∶3 1∶4 2∶3或2∶7
(3)Al2(SO4)3+8NaOH══2Na[Al(OH)4]+3Na2SO4
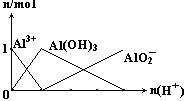
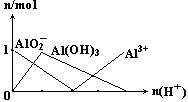
(2)(图象法):由下列反应得到下图:
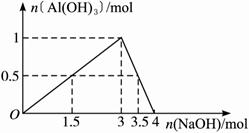
Al3++3OH-══Al(OH)3↓
Al3++4OH-══AlO2-+2H2O
设n(AlCl3)="1" mol,可见:Al3+与OH-的物质的量之比为1∶1.5或1∶3.5时,沉淀为最大量的一半。
(3)写成偏铝酸盐的形式
Al2(SO4)3+8NaOH══2NaAlO2+3Na2SO4+4H2O
并把Al(OH)-4看作AlO2-·2H2O,将Al(OH)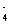 取而代之可得答案。
取而代之可得答案。

Al3++3OH-══Al(OH)3↓
Al3++4OH-══AlO2-+2H2O
设n(AlCl3)="1" mol,可见:Al3+与OH-的物质的量之比为1∶1.5或1∶3.5时,沉淀为最大量的一半。
(3)写成偏铝酸盐的形式
Al2(SO4)3+8NaOH══2NaAlO2+3Na2SO4+4H2O
并把Al(OH)-4看作AlO2-·2H2O,将Al(OH)
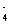 取而代之可得答案。
取而代之可得答案。
练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目

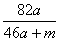 %
% %
%