题目内容
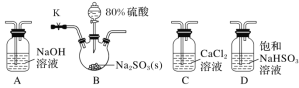
【题目】CuBr(溴化亚铜)是一种白色固体,不溶于水,在空气中会慢慢被氧化成绿色粉末,常用作催化剂,可用下图所示实验制得。
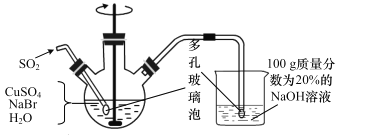
三颈烧瓶中的反应为 2Cu2++SO2+2Br-+2H2O=2CuBr↓+SO42-+4H+。
(1)实验所用蒸馏水需煮沸,目的是_______________。装置中使用多孔玻璃泡的目的是___________。
(2)将反应后得到的 CuBr 过滤并洗涤,检验 CuBr 是否洗净的方法是______。
(3)烧杯中若 NaOH 的量不足,则烧杯中最终所得溶液中的溶质是__________。
(4)CuBr 在空气中氧化所得绿色粉末为 xCuBr2·yCu(OH)2,为探究该粉末的化学式, 现进行如下实验:准确称取一定质量的绿色粉末,溶于足量乙酸中,用蒸馏水配制成 100 mL 溶液。
①取 25 mL 溶液,向其中加入足量的 AgNO3 溶液,充分反应后过滤、洗涤、干燥, 所得淡黄色固体质量为 0.94 g。
②另取 25 mL 溶液,向其中加入过量的 KI 溶液,再用 0.400mol·L-1Na2S2O3 标准溶液滴定至终点,消耗 25.00 mL。已知反应过程中的方程式如下:2Cu2++4I﹣=2CuI↓+I2、2S2O32-+I2=2I﹣+S4O62﹣。请确定该绿色粉末的化学式_________(需要计算过程)。
【答案】除去溶解在蒸馏水中的O2 使气泡与液体的接触面更大,反应更充分 取最后一次洗涤滤液少许,向其中加入 BaCl2 溶液,若无白色沉淀生成,说明已经洗涤干净,反之则未洗涤干净 NaHSO3 CuBr2·3Cu(OH)2
【解析】
(1)CuBr易被氧化,所以蒸馏水需煮沸的目的是除去溶解在蒸馏水中的O2;多孔玻璃泡使气泡与液体的接触面更大,反应更充分;
(2)由于溶液中含有硫酸根离子,则只需要检验硫酸根离子即可检验是否洗涤干净,即取最后一次洗涤滤液少许,向其中加入 BaCl2 溶液,若无白色沉淀生成,说明洗涤液不含硫酸根离子,CuBr已经洗涤干净,反之则未洗涤干净;
(3)氢氧化钠和过量的二氧化硫反应生成NaHSO3,烧杯中若 NaOH 的量不足,烧杯中最终所得溶液中的溶质是NaHSO3;
(4)n(Br﹣)=n(AgBr)=0.94 g÷188 g·mol-1=0.005 mol
即 n(CuBr2)=0.0025 mol
n(S2O32-)=0.400 molL-1×0.025 L=0.01 mol
根据2Cu2++4I﹣=2CuI↓+I2、2S2O32-+I2=2I﹣+S4O62﹣,有关系式Cu2+~S2O32-
n(Cu2+)=n(S2O32-)=0.01 mol;
根据电荷守恒 n(Cu2+)×2=n(Br﹣)+n(OH﹣)
n(OH﹣)=0.015 mol
所以 n[Cu(OH)2]=0.0075 mol
故绿色粉末的化学式为CuBr2·3Cu(OH)2。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
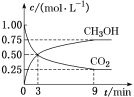
Ⅰ![]() 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃:![]() 在
在![]() 时,按
时,按![]() :
:![]() :3投料,图1所示不同温度
:3投料,图1所示不同温度![]() 下,平衡时的四种气态物质的物质的量
下,平衡时的四种气态物质的物质的量![]() 的关系.
的关系.
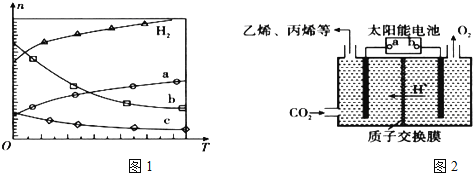
![]() 该反应的
该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 曲线b表示的物质为 ______ .
曲线b表示的物质为 ______ .
![]() 为提高
为提高![]() 的平衡转化率,除改变温度外,还可采取的措施是 ______ .
的平衡转化率,除改变温度外,还可采取的措施是 ______ .
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解![]() 可得到多种燃料,其原理如图2所示.
可得到多种燃料,其原理如图2所示.
b为电源的 ______ 极,电解时,生成乙烯的电极反应式是 ______ .
Ⅱ![]() (3)用活性炭还原法可以处理氮氧化物.如反应:
(3)用活性炭还原法可以处理氮氧化物.如反应:![]()
![]() . 在
. 在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
NO |
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
|
![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______ .
______ .
![]() 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______ ![]() 答一种即可
答一种即可![]() .
.
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的![]() ,分别生成
,分别生成![]() 、
、![]() ,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中![]() 较小的是 ______ ,用文字和化学用语解释原因 ______ .
较小的是 ______ ,用文字和化学用语解释原因 ______ .
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
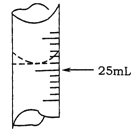
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数