题目内容
【题目】近日IPCC发布了由来自40个国家的91位科学家编写的《全球升温1.5℃特别报告》,温室效应引发的环境问题日益严重,物种灭绝,洪灾、旱灾、粮食欠收等自然灾害发生频率不断增加,CO2的减排和综合利用是解决温室及能源问题的有效途径。
(1)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
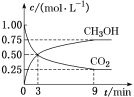
① 从3 min到9 min,v(H2)=_____mol·L-1·min-1。
② 该反应的平衡常数为_______。
③ 下列说法正确的的是____(填字母)。
A.混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态
B.平衡时CO2的转化率为75%
C.平衡时混合气体中CH3OH(g)的体积分数是30%
D.该条件下,第9 min时v逆(CH3OH)大于第3 min时v正(CH3OH)。
(2)工业中,CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。
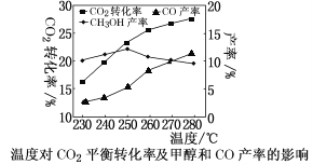
① 由图可知温度升高CO的产率上升,其主要原因可能是________。
② 由图可知获取CH3OH最适宜的温度是________。下列措施有利于提高CO2转化为CH3OH的平衡转化率的有___________(填字母)。
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
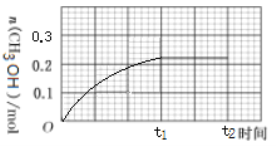
(3)250 ℃下CH3OH物质的量随时间的变化曲线如图所示。画出280 ℃下0~t2时刻CH3OH物质的量随时间的变化曲线示意图__________。
【答案】0.125 5.3 B C 反应B是吸热反应 250℃ B D 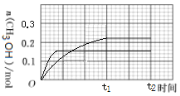
【解析】
(1)①3min到9min,根据CO2浓度变化计算CO2化学反应速率,利用计量数之比得到υ(H2);②结合各物质的平衡浓度,利用三段式法计算该反应的平衡常数;③A.该反应过程中密度为定值;B.根据二氧化碳的转化率=![]() ×100%计算平衡时CO2的转化率;C.平衡时混合气体中CH3OH(g)的体积分数等于平衡时甲醇的物质的量浓度与其它物质总物质的量浓度的百分比;D.该反应从开始至达到平衡状态,正反应速率逐渐减小,逆反应速率逐渐增大;
×100%计算平衡时CO2的转化率;C.平衡时混合气体中CH3OH(g)的体积分数等于平衡时甲醇的物质的量浓度与其它物质总物质的量浓度的百分比;D.该反应从开始至达到平衡状态,正反应速率逐渐减小,逆反应速率逐渐增大;
(2)①反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高;②据图示进行分析温度与甲醇转化率的关系;由CO2(g)+3H2(g)CH3OH(g)+H2O(g) 可知提高CO2转化为CH3OH平衡转化率,应使平衡向正向移动,可增大压强,增大浓度;
(3)根据温度对反应速率及化学平衡的影响分析。
(1)①3min到9min,CO2浓度变化为0.5mol/L-0.25mol/L=0.25mol/L,CO2反应速率=![]() =
=![]() mol/(Lmin),υ(H2)=3×υ(CO2)=0.125mol/(Lmin),故答案为:0.125;
mol/(Lmin),υ(H2)=3×υ(CO2)=0.125mol/(Lmin),故答案为:0.125;
② CO2(g) + 3H2(g)CH3OH(g)+H2O(g)
起始(mol/L) 1 3 0 0
转化(mol/L) 0.75 2.25 0.75 0.75
平衡(mol/L) 0.25 0.75 0.75 0.75
该反应的平衡常数K=![]() ≈5.3,故答案为:5.3;
≈5.3,故答案为:5.3;
③A.该反应前后都是气体,气体总质量始终不变,容器容积不变,则密度为定值,不能根据密度判断平衡状态,故A错误;B.平衡时CO2的转化率=![]() ×100%=75%,故B正确;C.平衡时混合气体中CH3OH(g)的体积分数=
×100%=75%,故B正确;C.平衡时混合气体中CH3OH(g)的体积分数=![]() ×100%=30%,故C正确;D.从反应开始到平衡过程中正反应速率逐渐减小,直至达到平衡状态,则第9min时达到平衡状态υ逆(CH3OH)=υ正(CH3OH),则9min时υ逆(CH3OH)一定小于第3min时υ正(CH3OH),故D错误;故答案为:BC;
×100%=30%,故C正确;D.从反应开始到平衡过程中正反应速率逐渐减小,直至达到平衡状态,则第9min时达到平衡状态υ逆(CH3OH)=υ正(CH3OH),则9min时υ逆(CH3OH)一定小于第3min时υ正(CH3OH),故D错误;故答案为:BC;
(2)①由图示可知,温度升高CO的产率上升,其主要原因可能是反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高,故答案为:反应B正反应是吸热反应;
②据图示可知,250℃甲醇产率最高,故获取CH3OH最适宜的温度是250℃;A.使用催化剂,平衡不移动,不能提高转化率,故A错误;B.增大体系压强,平衡向正方向移动,提高CO2转化率,故B正确;C.增大CO2和H2的初始投料比,可增大氢气的转化率,二氧化碳的转化率减小,故C错误;D.投料比不变,增加反应物的浓度,相当于增大压强,平衡正向移动,可增大转化率,故D正确;故答案为:250℃;BD;
(3)温度升高,反应速率加快,则反应达到平衡的时间小于t1;280℃时甲醇的产率小于250℃时,所以达到平衡后,体系中甲醇的量变小,据此画出280℃下0~t2时刻CH3OH物质的量随时间的变化曲线: ,故答案为:
,故答案为: 。
。