题目内容
【题目】镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)镍基态原子的核外电子排布式为________。
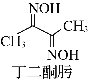
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为________。
(3)与CO互为等电子体的阴离子的化学式为__________________。
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为________。氨的沸点高于膦(PH3),原因是____________________________。
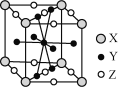
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为________(填化学式)。
【答案】[Ar]3d84s2(或1s22s22p63s23p63d84s2) sp3、sp2 CN- 28 mol NH3分子间可形成氢键,而PH3分子间不能 H2
【解析】
(1)镍在元素周期表中的原子序数为28,根据原子的构造原理书写;
(2)根据结构简式中碳原子的键连方式分析;
(3)等电子体是指一类分子或离子,组成它们的原子数相同,而且所含的价层电子数相同;
(4) [Ni(NH3)6]SO4中的配位键和单键都为σ键。PH3分子之间为范德华力,氨气分子之间形成氢键,增大了物质的沸点;
(5)根据均摊法计算晶胞中各微粒的数目,进而分析判断X、Y、Z代表的微粒。
(1)镍在元素周期表中的原子序数为28,根据原子的构造原理,镍基态原子的核外电子排布式为[Ar]3d84s2(或1s22s22p63s23p63d84s2);
(2)根据丁二酮肟的结构简式,其中中碳原子既有单键又有双键,碳碳单键上的碳原子的杂化类型是sp2,碳碳双键上的碳原子的杂化类型是sp3杂化;
(3)等电子体是指一类分子或离子,组成它们的原子数相同,而且所含的价层电子数相同,CO含有2个原子,价层电子数为14个电子,与CO互为等电子体的阴离子有 CN-或C22-等;
(4) [Ni(NH3)6]SO4中Ni2+与6个NH3形成6个配位键属于σ键,NH3形成3个氮氢单键为σ键,SO42-中含有4个σ键,所以1 mol [Ni(NH3)6]SO4中σ键的数目=1 mol×(6+6×3+4)=28mol; PH3分子之间为范德华力,氨气分子之间形成氢键,分子间作用力更强,增大了物质的沸点,故氨气的沸点高于PH3分子的;
(5)晶胞中X位于晶胞的顶点,数目=8×![]() =1、Y位于晶胞的体心和面上,数目=1+8×
=1、Y位于晶胞的体心和面上,数目=1+8×![]() =5、Z位于晶胞的面和棱上,数目=8×
=5、Z位于晶胞的面和棱上,数目=8×![]() +2×
+2×![]() =3,则该物质的组成为XY5Z3,结合化学式LaNi5H6,可知X代表La、Y代表Ni、Z代表H2。
=3,则该物质的组成为XY5Z3,结合化学式LaNi5H6,可知X代表La、Y代表Ni、Z代表H2。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】对甲基苯乙酮是重要的化工原料,某实验小组利用如图装置制备对甲基苯乙酮。

制备原理: (放热反应)。 反应物和产物的相关数据列表:
(放热反应)。 反应物和产物的相关数据列表:
试剂名称 | 分子式 | 分子量 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 |
甲苯 | C7H8 | 92 | -93 | 110.6 | 0.8669 |
乙酸酐 | (CH3CO)2 | 102 | -73.1 | 138.6 | 1.08 |
对甲基苯乙酮 | C9H10O | 134 | 28 | 94(0.93kPa) | 1.0051 |
实验步骤:
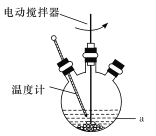
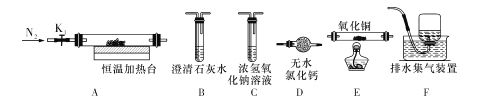
步骤 1:如图所示,在 100mL 三颈烧瓶上安装搅拌器、仪器 x 和上口装有无水氯化钙的冷凝管,干燥管与一气体 吸收装置相连。
步骤 2:三颈烧瓶中快速加入研碎的催化剂和 20mL 无水甲苯,在搅拌的条件下通过仪器 x 缓慢地滴加 3.4mL 醋酸酐与 5mL 甲苯的混合液,约需 15min 滴完。
步骤 3:反应结束后,将三颈烧瓶在 95℃时加热 25~30min。
步骤 4:反应混合液冷却后转移到盛有 30mL 浓盐酸与 30mL 冰水的烧杯中(目的是将对甲基苯乙酮从其与铝的化 合物中分离出来),用分液漏斗分出有机层、水层。每次用 5mL 甲苯萃取两次,并将所有甲苯层合并,然后依次 用水、10%氢氧化钠溶液、水各 10mL 洗涤有机层,最后用无水硫酸镁处理。
步骤 5:将干燥后的溶液滤入蒸馏瓶,减压蒸馏(整套装置必须是干燥的),收集 94℃(0.93kPa)馏分,得到对甲 基苯乙酮 4.1g。
请回答下列问题:
(1)仪器 x 的名称为________。与普通的分液漏斗相比,本实验采用仪器 x 的优点为_______。
(2)本实验中的氯化铝若水解则会影响催化效率,除了使用干燥管的措施外,还应该采取哪些措施防止水解_____(答两点)。
(3)步骤③中最适宜的加热方式为 _____。
(4)步骤④中加入 10%的氢氧化钠溶液的目的为 _____,加入无水硫酸镁的目的为_________。
(5)步骤④中水层每次用 5mL 甲苯萃取两次并将所有甲苯层合并的目的为________。
(6)步骤⑤中减压蒸馏时所需的冷凝装置能否选用题给装置图中的球形冷能管_____(答“能”或“不能”)。 本实验中,对甲基苯乙酮的产率为_____(结果保留 2 位有效数字)。