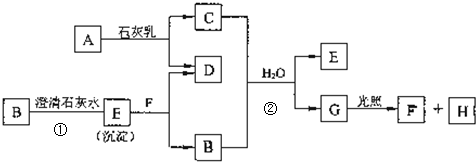
题目内容
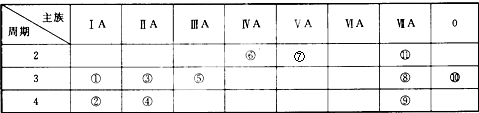
如图为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题.
(1)化学性质最不活泼的元素是 (填元素符号,下同),非金属性最强的元素是 .金属性最强的单质与水反应的离子方程式是 .
(2)①②③三种元素的原子半径由大到小的顺序是 .
(3)③⑧两种元素形成的化合物的电子式为 .
(4)⑤的离子结构示意图为 .
(5)⑦的最高价氧化物的水化物与其氢化物反应的产物化学式为 ,该物质属于 (填离子或共价)化合物.

(1)化学性质最不活泼的元素是
(2)①②③三种元素的原子半径由大到小的顺序是
(3)③⑧两种元素形成的化合物的电子式为
(4)⑤的离子结构示意图为
(5)⑦的最高价氧化物的水化物与其氢化物反应的产物化学式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Cl、⑨为Br、⑩为Ar、⑾为F.
(1)稀有气体化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)③⑧两种元素形成的化合物MgCl2,由镁离子与氯离子构成;
(4)铝离子质子数为13,核外电子数为10,有2个电子层,构成电子数为2、8;
(5)氮元素的最高价氧化物的水化物与其氢化物反应的产物为硝酸铵,属于离子化合物.
(1)稀有气体化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)③⑧两种元素形成的化合物MgCl2,由镁离子与氯离子构成;
(4)铝离子质子数为13,核外电子数为10,有2个电子层,构成电子数为2、8;
(5)氮元素的最高价氧化物的水化物与其氢化物反应的产物为硝酸铵,属于离子化合物.
解答:
解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Cl、⑨为Br、⑩为Ar、⑾为F.
(1)稀有气体Ar化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故F元素非金属性最强,K的金属性最强,K与水反应生成KOH与氢气,反应离子方程式为:2K+2H2O=2K++OH-+H2↑,
故答案为:Ar;F;2K+2H2O=2K++OH-+H2↑;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,
故答案为:K>Na>Mg;
(3)③⑧两种元素形成的化合物MgCl2,由镁离子与氯离子构成,电子式为: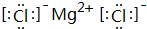 ,故答案为:
,故答案为: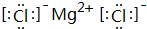 ;
;
(4)铝离子质子数为13,核外电子数为10,有2个电子层,构成电子数为2、8,离子结构示意图为: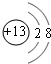 ,故答案为:
,故答案为: ;
;
(5)氮元素的最高价氧化物的水化物与其氢化物反应的产物为硝酸铵,化学式为NH4NO3,属于离子化合物,故答案为:NH4NO3;离子.
(1)稀有气体Ar化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故F元素非金属性最强,K的金属性最强,K与水反应生成KOH与氢气,反应离子方程式为:2K+2H2O=2K++OH-+H2↑,
故答案为:Ar;F;2K+2H2O=2K++OH-+H2↑;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,
故答案为:K>Na>Mg;
(3)③⑧两种元素形成的化合物MgCl2,由镁离子与氯离子构成,电子式为:
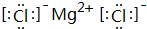 ,故答案为:
,故答案为: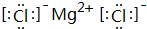 ;
;(4)铝离子质子数为13,核外电子数为10,有2个电子层,构成电子数为2、8,离子结构示意图为:
 ,故答案为:
,故答案为: ;
;(5)氮元素的最高价氧化物的水化物与其氢化物反应的产物为硝酸铵,化学式为NH4NO3,属于离子化合物,故答案为:NH4NO3;离子.
点评:本题考查元素周期表与元素周期律综合应用,比较基础,需要学生熟练掌握周期表,有利于对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将3.48g Fe3O4完全溶解在100mL 1mol?L-1硫酸中,然后加入一定体积的0.1mol?L-1的K2Cr2O7溶液,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-全部还原为Cr3+,则加入K2Cr2O7溶液的体积为( )
| A、15mL | B、25mL |
| C、35mL | D、50mL |
下列各组离子在特定条件下一定能够大量共存的是( )
| A、含有较多Fe3+的溶液:Na+、SO42-、HS-、NH4+ |
| B、c(OH-)=1mol/L的溶液:AlO2-、CH3COO-、K+、Ba2+ |
| C、pH=1的溶液:K+、Fe2+、NO3-、Na+ |
| D、遇Al能放出H2的溶液:HCO3-、K+、Mg2+、Cl- |
 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.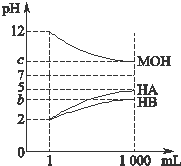 为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题:
为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题: