题目内容
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
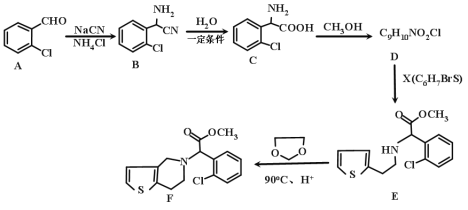
(1)A的化学名称是________,B的分子式是_____________。
(2)C中含氧官能团的名称为________。)
(3)请写出 C→D 的化学方程式为___________,其反应类型是________。
(4)G是C的同系物,且少一个碳原子,则G的结构有_____种。
(5)X的结构简式为___________。
(6)已知: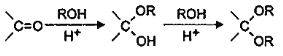 ,则由乙烯、甲醛为有机原料制备化合物
,则由乙烯、甲醛为有机原料制备化合物![]() ,请写出合成路线________(无机试剂任选)
,请写出合成路线________(无机试剂任选)
【答案】邻氯苯甲醛或2-氯苯甲醛,C8H7N2Cl 羧基  酯化反应或取代反应 10
酯化反应或取代反应 10 ![]()
![]() C2H4
C2H4
【解析】
(1)有机物命名的原则可知A的名称是邻氯苯甲醛或2-氯苯甲醛,有B的结构简式可知其分子式是C8H7N2Cl,
故答案为:邻氯苯甲醛或2-氯苯甲醛;C8H7N2Cl
(2)有C的结构简式可知其含有的官能团是羧基,
故答案为:羧基
(3)C与甲醇反应生成D,其反应的化学方程式是
故答案为:
(4)G是C的同系物,且少一个碳原子,根据同分异构体的书写规律可知其同分异构体有10种,
故答案为:10
(5)有D与X生成E,知道D与E的结构简式,可以推出X的结构简式是![]()
故答案为:![]()

 阅读快车系列答案
阅读快车系列答案【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为_________________________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________________________________________。
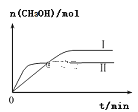
(3)①CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为______________________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是______________。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
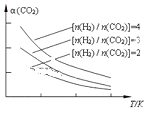
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。