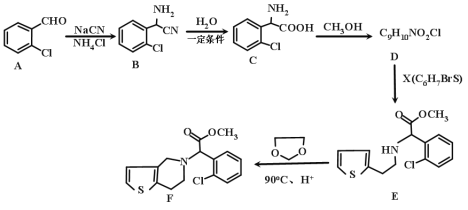
题目内容
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。②Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成 KC1O3。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3 胶体,写出该反应的离子方程式:____________________________。
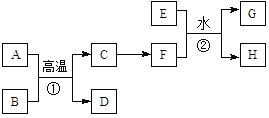
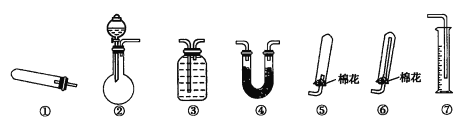
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:___________________________。
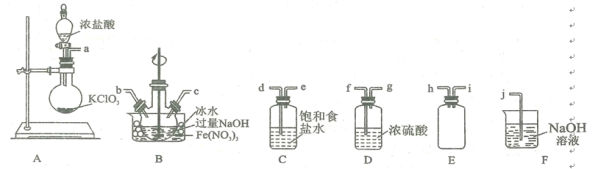
(3)写出装置A中发生的离子方程式: ______________________ 。
(4)三颈烧瓶用冰水浴的原因是 _________________,A处盛放KC1O3的仪器名称 ___________。
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是________________________________________________________。
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42- 形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加人稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为_________。
【答案】4FeO42- +10 H2O = 4Fe(OH)3 (胶体) + 8OH- + 3O2 ↑ adebcj (或adecbj) ClO3- +6H+ +5Cl-=3Cl2↑+3H2O 防止Cl2与KOH反应生成KClO3而得不到KClO 圆底烧瓶 相同条件下,K2FeO4的溶解度小于Na2FeO4的溶解度(说法合理即可) 52.8%
【解析】
(1)由题可知,K2FeO4与水反应生成Fe(OH)3 胶体,Fe元素化合价降低,根据化合价升降规则可知,O元素化合价升高,生成氧气,根据化合价升降守恒、原子守恒、电荷守恒可写出其离子方程式为:4FeO42- +10H2O = 4Fe(OH)3 (胶体) + 8OH- + 3O2 ↑;
(2)装置A为制备氯气装置,B为制备NaClO后与NaOH、Fe(NO3)3反应制备Na2FeO4的装置,装置C为除去氯气中氯化氢装置,装置D为气体干燥装置,装置E为安全瓶或储存气体装置,装置F为除尾气装置,
根据实验要求,本实验需要装置为A、B、C、F,装置A制备的氯气经过除氯化氢后,通入装置B中进行反应制备Na2FeO4,未反应完全的气体经过尾气处理,故装置的接口连接顺序为:adebcj (或adecbj);
(3)装置A为制备氯气装置,KClO3与浓盐酸反应的离子方程式为:ClO3- +6H+ +5Cl-=3Cl2↑+3H2O;
(4)因该反应为放热反应,而Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成 KC1O3,因此需要用冰水浴保持反应温度在20℃以下,防止Cl2与KOH反应生成KClO3而得不到KClO;根据仪器图可知,盛放KClO3的仪器为圆底烧瓶;
故答案为:防止Cl2与KOH反应生成KClO3而得不到KClO;圆底烧瓶;
(5)由K2FeO4微溶于KOH溶液可知,K2FeO4在KOH溶液中溶解度小于Na2FeO4,因此将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,
故答案为:相同条件下,K2FeO4的溶解度小于Na2FeO4的溶解度;
(6)由反应方程式:a、FeO42+CrO2+2H2O=CrO42+Fe(OH)3↓+OH、
b、2CrO42+2H+=Cr2O72+H2O、
c、Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O
可得关系式:FeO42CrO2![]() Cr2O723Fe2+,
Cr2O723Fe2+,
则每次滴定反应的K2FeO4的物质的量为:n(K2FeO4)=![]() ( Fe2+)=
( Fe2+)=![]() ×24.00×10-3L×0.1mol/L=8×10-4mol,
×24.00×10-3L×0.1mol/L=8×10-4mol,
则K2FeO4的总质量为:198g/mol×8×10-4mol×![]() =1.584g,
=1.584g,
则K2FeO4的样品纯度为:![]() ×100%=52.8%。
×100%=52.8%。

【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
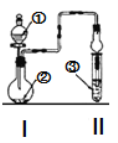
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D