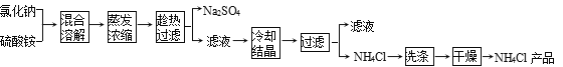
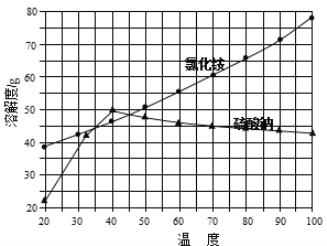
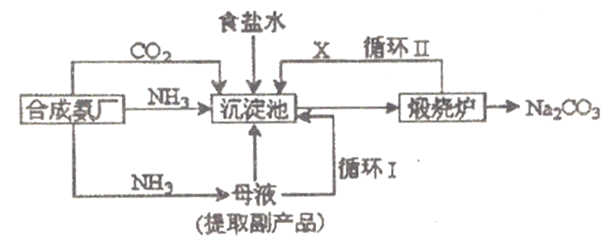
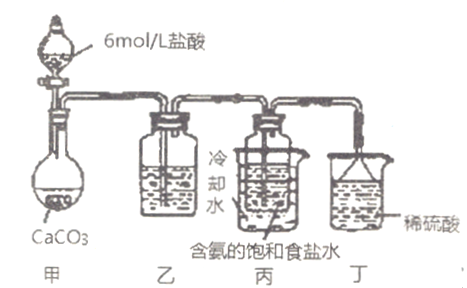
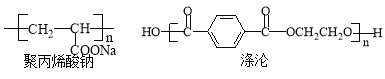
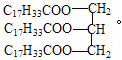��Ŀ����
����Ŀ����1��ʵ��������1000mL0.50mol��L-1��Na2CO3��Һ���ڳ���������Ӧѡ��______mL������ƿ������ʱ��������������̣�1g���������룩�������Ƶ���Һ�����ʵ���Ũ��______0.50mol��L-1������ڡ�����С�ڡ����ڡ�����
��2��������Ϻ��ñ�Na2CO3��Һ�ζ�δ֪Ũ�ȵ�����ʱ��Na2CO3��ҺӦװ��______ʽ�ζ����С�������������Na2CO3��Һ�ζ����ζ�ʱʵ�������б����£�
������� | �������������mL�� | ����Na2CO3��Һ�����mL�� |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
��c(HCl)=______mol��L-1��
��3����ʢװNa2CO3��Һ�ĵζ����ڵζ�ǰδ�ñ�Һ��ϴ���������������Ũ��______����ԭ����������ȡ��Na2CO3�����л���Na2CO3��10H2O����ʵ�����Ϊ______�����������ƫ�ߡ�����ƫ�͡�����Ӱ�족��
��4����������20 mL 0.1 mol��L��1 Na2CO3��Һ����μ���0.1 mol��L��1 HCl��Һ40 mL����ҺpH���ͣ���ʱ��Һ�к�̼Ԫ�ص��������ʵ���Ũ�ȵİٷֺ���(����)�����ı仯(CO2���ݳ�δ����)��ͼ��ʾ������ͼʾ�ش��������⣺

����д��AB�η�Ӧ�����ӷ���ʽ___________________________________
����Ӧ��A��ʱ����Һ�����������Ӻ������ӵ�Ũ�ȴ�С��ϵΪ(������Ũ�ȳ���)_____________________________________________________________________________
���𰸡� 1000 ���� �� 0.85 ƫ�� ƫ�� H+��CO32-��HCO3- c(Na+)>c(CO32-)��c(HCO3-)>c(OH��)>c(H+)
�����������⿼����Һ�������Լ��к͵ζ���������1��ʵ��������1000mL��Һ��Ӧѡ��1000mL������ƿ������n=cV=0.50mol/L��1L=0.50mol����̼���Ƶ�����Ϊ��0.50 mol��106g/mol=53.0g������ʱ������������̣���δʹ�����룬��Ƶõ�̼���Ƶ�����û�����������Ƶ���Һ�����ʵ���Ũ�ȵ���0.50molL��1����2��̼������ǿ�������Σ�ˮ���ʼ��ԣ�Ӧװ�ڼ�ʽ�ζ����У��ɱ����е����ݿ�֪����1��ʵ����������ϴ�Ӧ��ȥ������������̼���Ƶ����ƽ��ֵΪ�� ![]() mL=17.00mL�����ݹ�ϵʽ��2HCl��Na2CO3��n��HCl��=2n��Na2CO3��=2��0.50mol/L��17.00��10��3L��c=
mL=17.00mL�����ݹ�ϵʽ��2HCl��Na2CO3��n��HCl��=2n��Na2CO3��=2��0.50mol/L��17.00��10��3L��c=![]() =
=![]() ����3����ʢװNa2CO3��Һ�ĵζ����ڵζ�ǰδ�ñ�Һ��ϴ��ʹ̼���Ƶ�Ũ�ȱ�С������̼���Ƶ�������࣬����c�����⣩=
����3����ʢװNa2CO3��Һ�ĵζ����ڵζ�ǰδ�ñ�Һ��ϴ��ʹ̼���Ƶ�Ũ�ȱ�С������̼���Ƶ�������࣬����c�����⣩=![]() ��֪�����������Ũ��ƫ�ߣ���ԭ����������ȡ��Na2CO3�����л���Na2CO310H2O��ʹ��Һ������̼���Ƶ��������٣�Ũ��ƫ�ͣ��ζ����յ�ʱ�����ĵ�̼���Ƶ����ƫ����������Ũ��ƫ�ߣ���4����OAB��c(HCO3��)Ũ������c(CO32��)Ũ�ȼ�С��˵��CO32����H+��Ӧ����HCO3�������ӷ���ʽΪ��CO32��+H+=HCO3������A��ʱ��c(CO32-)��c(HCO3-)����Һ�е�����Ϊ̼���ơ�̼�����ơ��Ȼ��ƣ���Һ��̼�������ˮ����ڵ����̼������ʼ��ԣ���c(OH��)>c(H+)��Na2CO3����ԭ��Ϊ̼ԭ�ӵ�2��������Һ�����������Ӻ������ӵ�Ũ�ȴ�С��ϵΪ(������Ũ�ȳ���)��c(Na+)>c(CO32-)��c(HCO3-)>c(OH��)>c(H+)��
��֪�����������Ũ��ƫ�ߣ���ԭ����������ȡ��Na2CO3�����л���Na2CO310H2O��ʹ��Һ������̼���Ƶ��������٣�Ũ��ƫ�ͣ��ζ����յ�ʱ�����ĵ�̼���Ƶ����ƫ����������Ũ��ƫ�ߣ���4����OAB��c(HCO3��)Ũ������c(CO32��)Ũ�ȼ�С��˵��CO32����H+��Ӧ����HCO3�������ӷ���ʽΪ��CO32��+H+=HCO3������A��ʱ��c(CO32-)��c(HCO3-)����Һ�е�����Ϊ̼���ơ�̼�����ơ��Ȼ��ƣ���Һ��̼�������ˮ����ڵ����̼������ʼ��ԣ���c(OH��)>c(H+)��Na2CO3����ԭ��Ϊ̼ԭ�ӵ�2��������Һ�����������Ӻ������ӵ�Ũ�ȴ�С��ϵΪ(������Ũ�ȳ���)��c(Na+)>c(CO32-)��c(HCO3-)>c(OH��)>c(H+)��