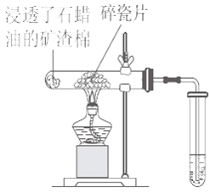
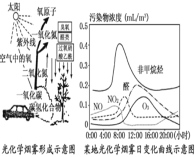
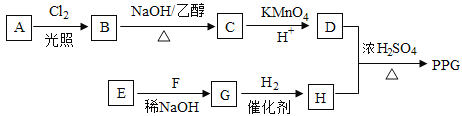
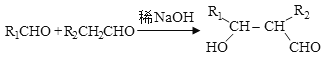题目内容
【题目】某温度下,水的离子常数KW=10—13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。
(1)若所得混合溶液为中性,则a:b=________,生成沉淀物质的量为______mol(用含b表达式来表示)。
(2)若a:b=9:2,则所得溶液pH=_____。该混合溶液最多能溶解铁粉_______g(用含a、b表达式表示)。
【答案】(1)10:1;0.05b;(2)2;0.28(a+b)
【解析】
试题分析:某温度时,水的离子积常数KW=10-13,pH=11的Ba(OH)2溶液中氢氧根离子浓度为0.01mol/L,pH=1的H2SO4溶液中氢离子浓度为0.1mol/L,
(1)若所得混合液为中性,酸碱恰好完全反应,则有:n(H+)=n(OH-),即:0.01mol/L×aL=0.1mol/L×bL,a:b=0.1:0.01=10:1,Ba2++SO42-=BaSO4↓,用硫酸根计算沉淀物质的量=![]() ×bL=0.05bmol;或用钡离子计算沉淀物质的量=
×bL=0.05bmol;或用钡离子计算沉淀物质的量=![]() ×aL=0.005amol;故答案为:10:1;0.05bmol或0.005amol;
×aL=0.005amol;故答案为:10:1;0.05bmol或0.005amol;
(2)若a:b=9:2,而a:b=10:1时二者恰好反应,说明酸过量,若所得混合液的pH=2,酸过量,c(H+)=![]() ,将a=
,将a=![]() b代入可得,c(H+)=0.01mol/L,溶液pH=2;铁与氢离子反应的关系式为:Fe~2H+,n(Fe)=
b代入可得,c(H+)=0.01mol/L,溶液pH=2;铁与氢离子反应的关系式为:Fe~2H+,n(Fe)=![]() n(H+),所以该溶液最多溶解的铁的质量为:m(Fe)=56g/mol×
n(H+),所以该溶液最多溶解的铁的质量为:m(Fe)=56g/mol×![]() 0.01mol/L×(a+b)L=0.28(a+b)g,a:b=9:2时所得溶液的pH为2;该混合溶液最多能够溶解铁粉的质量为0.28(a+b)g,故答案为:2;0.28(a+b)。
0.01mol/L×(a+b)L=0.28(a+b)g,a:b=9:2时所得溶液的pH为2;该混合溶液最多能够溶解铁粉的质量为0.28(a+b)g,故答案为:2;0.28(a+b)。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案